学科紹介 キーワード解説
| ゲノム情報医科学研究室 | |
|---|---|
| 再生医科学研究室 | |
| 幹細胞制御学研究室 | |
| 腫瘍医科学研究室 | |
| 免疫制御学研究室 | |
| 細胞制御医科学研究室 | |
| 分子細胞生物学研究室 |
遺伝子(Gene)
遺伝情報を担う、デオキシリボ核酸(DNA)から成る構造単位です(但し、RNAウイルスではリボ核酸(RNA))。細胞の核の中に存在する高分子DNAの特定の領域の塩基配列を指します。遺伝子の塩基配列は、1つあるいは1連のタンパク質やRNAに相当します。
タンパク質やRNAといった遺伝子産物の発現は、生物の発達段階、臓器や細胞の種類などに応じて厳密に制御されています。その制御システムが正常に働かない場合、特定の遺伝子領域の増幅、特定遺伝子の変異、異なる遺伝子同士の部分的融合などが生じ、病気の原因となることがあります。癌などはその代表例です。
特定遺伝子を除いた(欠損)マウスや、遺伝子産物の発現を抑制した各種細胞を作製する技術が開発されており、様々な病気の発症や悪化機構の解明、治療法開発に利用されています。
癌(Cancer)
悪性腫瘍のうち、特に上皮細胞から派生した悪性腫瘍を指します。悪性腫瘍は、細胞分裂の抑制を無視して増殖し、さらに周囲の組織に浸潤する能力を獲得しています。癌細胞は、血管やリンパ管に入り、体内の別の場所に転移し、二次腫瘍を形成します。
癌細胞が広範囲に転移をすればするほど根絶が難しくなります。多くの癌は、いくつかの遺伝子の活性化や不活性化を引き起こす変異に伴って進行しているため、癌の原因となる遺伝子を見つけ出すことで、それぞれの癌に有効な分子標的治療薬を開発する試みが盛んに行われています。
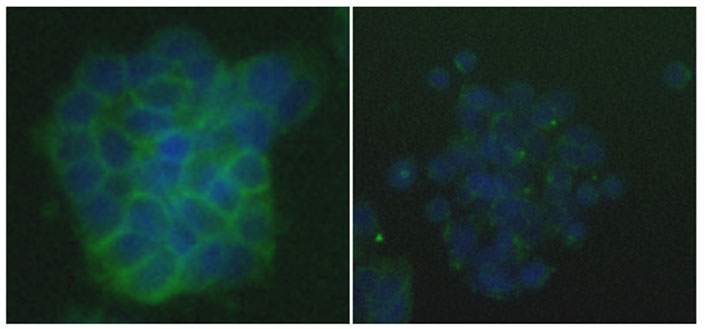 癌細胞の悪性度の指標として上皮性を検討した。上皮性を保持している癌細胞(左、良性)と上皮性を失った癌細胞(右、悪性)を示す。
癌細胞の悪性度の指標として上皮性を検討した。上皮性を保持している癌細胞(左、良性)と上皮性を失った癌細胞(右、悪性)を示す。
Eカドヘリン(上皮性細胞間接着因子;緑)、核(青)
脂質
脂質はタンパク質、糖質とともに生体を構成する物質群である。脂質はアルコールと脂肪酸のみがエステル結合している単純脂質と分子中にリン酸や糖などを含む複合脂質に分類され、単純脂質は主に生体内にエネルギーを貯蔵する役割を持つ。また複合脂質のうちリン脂質は生体膜の主要な構成成分である。これらの働きに加え、脂質は各種脂質結合タンパク質を介して様々な細胞応答に関与する。脂質はゲノムに直接コードされておらず、その量は脂質代謝酵素群により調節されており脂質代謝酵素による脂質量の調節は正常な細胞機能の維持に必須である。
皮膚炎
皮膚は表皮角化細胞、線維芽細胞、各種免疫細胞、脂肪細胞等の多様な細胞により構成され、体重の約1 / 6の重量を持つ人体最大の臓器である。皮膚は体内と体外を物理的に隔てており体内からの過剰な水分蒸散を防ぎ、体外の刺激から体内を保護する働きを持つ。さらに皮膚は体外からの刺激に対して免疫システムによる防御反応を起こして対応しようとする。この際、免疫システムによる過剰な防御反応がおきると皮膚炎が引き起こされる。
代表的な皮膚炎としてアトピー性皮膚炎や接触皮膚炎などがある。アトピー性皮膚炎は体質的な要因や環境的な要因が影響する「多因子性」の病気であり、皮膚のバリア機能に必須なタンパク質であるフィラグリンをコードする遺伝子の変異による皮膚バリア機能の低下が発症因子の一つであると考えられている。接触皮膚炎とはいわゆる「かぶれ」のことであり、酸やアルカリなどの化学物質が皮膚に接触することでおきる刺激性接触皮膚炎とアレルゲンへの繰り返しの接触により免疫細胞が活発化しておきるアレルギー性接触皮膚炎の2種類に大きく分類される。
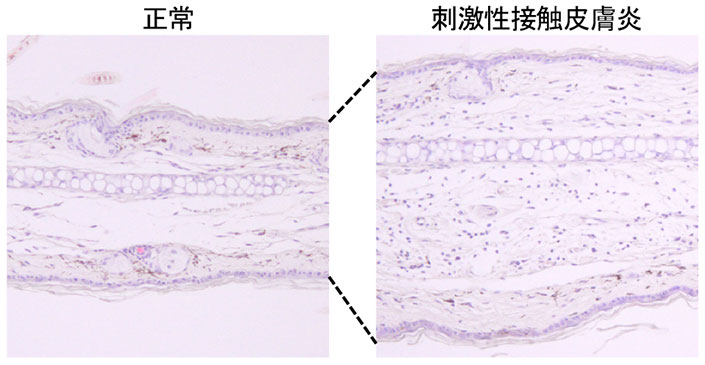 正常な皮膚組織と刺激性接触皮膚炎を起こした皮膚組織
正常な皮膚組織と刺激性接触皮膚炎を起こした皮膚組織
創薬
新しい薬になる可能性のあるものを開発すること。歴史的には、薬効のある天然物(主に植物等)からその成分を同定し、その成分を合成する手法が行なわれてきた。代表的なものとしては青カビからのペニシリンや、ケシ(アヘン)から抽出したモルヒネ、樹皮からのキニーネなど。その後低分子量化合物ライブラリーをスクリーニングし、がん細胞の増殖を止める抗がん剤などの創薬シーズを探し、副作用を軽減するなど改良した医薬品開発が盛んに行なわれた。
近年は、疾病発症の原因となる遺伝子やメカニズムを同定し、それらをターゲットとする分子標的薬の開発が行なわれてきている。特に、低分子量化合物の他、ターゲットとなるタンパク質に対する抗体を用いた抗体医薬が脚光を浴びている。分子標的薬の代表的なものとしては、上皮増殖因子受容体(EGFR)をターゲットとしたイレッサ(肺がん治療薬)、Bcl-Ablがん遺伝子をターゲットにしたグリベック(慢性骨髄性白血病薬)、TNFα抗体レミケード(関節リューマチ薬)等がある。
 低分子化合物スクリーニングの様子
低分子化合物スクリーニングの様子
がんの進展を抑制するタンパク質の発現を回復させる低分子化合物を探索している
DNAダメージ
ゲノムDNAは、生物の構造や働きをきめる設計図であると言われます。私たち人間の体を形づくっている様々な細胞は、核の中にDNAをもっており、細胞が増殖する時には、DNAはコピー(複製)され、分裂した細胞に正確に分配されなければなりません。さらに、生殖細胞で複製されたDNAは、子孫にその遺伝情報を正確に伝えなければなりません。
しかしながら、DNAは常に安定であるわけではなく、非常に傷つきやすいことがわかっています。例えば、酸素呼吸によってミトコンドリアから発生する活性酸素や、紫外線や放射線、環境由来の化学物質や喫煙などによって攻撃され、DNAの化学的な構造変化であるDNAダメージが頻繁に発生しています。そのため、私たちの細胞にはこのDNAダメージに対抗し、もとの状態に修復するためのシステム、すなわちDNA修復機構が備わっています。分子生化学研究室では私たちの体のなかでおこなわれている、このDNAダメージに対する修復機構について研究しています。
こころの病気
こころの病気とは、発達障害や精神疾患と呼ばれている病気のことを指します。具体的には統合失調症や自閉症、アスペルガー症候群、うつ病やPTSD(心的外傷後ストレス障害)などを含みます。近年では、「大人の発達障害」と言われるような、成人してからの社会性やコミュニケーション能力などの欠除により障害が指摘されるケースが増えています。「うつ」や「ニート」、「引きこもり」などの原因となっている可能性が指摘されており、こころの病気の発症機構を解明することは大きな社会的課題となっています。
こころの病気は、主に脳の発生の間において何らかの障害をきたすことで生じると考えられています。神経細胞や神経突起の数や形態、神経細胞同士のつながりの場であるシナプスにおける信号伝達や伝達物質の変化などが原因として指摘されています。治療に使われる薬は、神経伝達物質の再取り込みの阻害などにより伝達物質量を制御することで症状を緩和するものが主に用いられています。しかし、こころの病気は遺伝的要因と環境要因が発症の要因とされており、発症の詳しいメカニズムはほとんど明らかとなっていません。
分子生化学研究室では、統合失調症の有力な原因遺伝子と相互作用するまったく新しい遺伝子を発見しました。現在この遺伝子のみを発現できなくさせたマウス(ノックアウトマウス)を作成し、こころの病気の発症メカニズムの解明とその治療法の開発を目指しています。
記憶・学習
記憶や学習といった一連の現象は、脳の中では神経細胞同士のつながりと密接な関連があります。そのつながりの部分はシナプスと呼ばれ、神経伝達物質による信号伝達が行われています。シナプスは変化しないものではなく、その形態は信号の大きさや頻度によって動的に変化していることが明らかとなってきました(シナプスの可塑性)。神経伝達物質の放出や受容、シナプスの形態の制御や細胞内での情報の伝達など遺伝子や蛋白質レベルでの研究が日進月歩で行われています。
ヒトの脳には約1,000億個の神経細胞が存在し、1つの神経細胞は1,000から10,000くらいのシナプス入力を受けていると考えられています。それらの情報は神経細胞のネットワークを介して多角的に処理され、その結果が個体の行動として表現されます。シナプスの異常は記憶や学習・認知障害や痴呆などの原因と考えられており、シナプス可塑性の詳細な分子メカニズムを解明することで新規の薬剤の開発等に役立つのではないかと期待されています。
分子生化学研究室では記憶形成や学習行動に関与する遺伝子の研究を分子、細胞、個体(マウス)の各レベルで研究しています。
神経変性疾患
神経変性疾患とは簡単にいうと、壊れたタンパク質が神経細胞の中にたまってしまう病気です。蓄積した変性タンパク質は、徐々に細胞の機能を障害して、最終的に細胞死を誘導します。代表的なものとしては、アルツハイマー病、パーキンソン病、ポリグルタミン病といったものがあります。
たとえばアルツハイマー病は、アミロイドβという変性タンパク質が大脳皮質の神経細胞にたまることにより、記憶障害や認知機能の低下(痴呆症)をひきおこします。
パーキンソン病では、変異をおこしたα-シヌクレインなどの変性タンパク質が神経細胞に蓄積することにより、固縮・振戦などの症状をひきおこします。
また、脊髄小脳変性症は、ふらつきなどの小脳失調症状が現れますが、異常に伸長したポリグルタミン変性蛋白質が小脳・脳幹・脊髄にたまることが原因であると考えられています。
ミトコンドリア
ミトコンドリアは生体内におけるエネルギー産生工場であるとはよく知られていますが、それ以外にも多岐にわたる代謝を担っています。さらに近年の研究の進歩がミトコンドリアの新しい機能を明らかにしていくのに従い、老化やがん、神経変性などの疾患とも関わりも深いことがわかってきました。さまざまな疾患においてミトコンドリアが受ける病的な影響によりミトコンドリアにおきる変化やミトコンドリアが起こす応答が、どのように病態の形成に関与していくのかを研究することは、疾患の成り立ちや治療法開発の上で重要であると考えられます。
動脈硬化
動脈硬化は、血管の壁にコレステロールが沈着することでプラークが形成され、血液の流れを悪くします。ひどくなると虚血性心疾患(心筋梗塞)や脳卒中を引き起こし、生命を危険にさらすことになります。動脈硬化の危険因子として、高コレステロール血症、高血圧、糖尿病、肥満などの生活習慣病と遺伝的素因があります。心血管医科学研究室では、動脈硬化の分子メカニズムを解明し、世界第一位の死因である虚血性心疾患の予防・治療に役立つ研究をしております。
ペプチドサイエンス
ペプチドとは、タンパク質の素になるアミノ酸が少なくとも2個以上結合したもので、タンパク質より小さいサイズのものを指します。心血管医科学研究室では、このペプチドを基にサイエンスを駆使して心血管病の早期発見や予防・治療法の開発に努めております。既に知られているペプチドに加え、コンピューター上、新たなアミノ酸配列を設計後に合成した新規ペプチドを動脈硬化にとって悪玉か善玉かを実験にて識別し、悪玉であればそれをブロックする薬剤、善玉であればその特徴を有するアナログ製剤又はそれを体内で増やす薬剤を精製し、動脈硬化の治療に役立てようとしております。また我々の血液中に悪玉ペプチドの増加や善玉の極端な減少をもって、体内に病気が潜んでいることを把握するための診断薬(バイオマーカー)を作り出そうとしております。
血管新生
血管新生とは、既存の血管から新たに血管が形成される過程をいい、血管新生促進因子と抑制因子のバランスによって厳密に制御されている。血管新生は、個体の発生や成長期、妊娠、創傷治癒などの生理的条件下で誘導される過程であり、大部分の血管では血管新生は誘導されず、血管を構成する血管内皮細胞は休止状態におかれている。それゆえ血管新生の恒常性維持が破綻した状態は疾患との関連が深い。
血管新生異常の典型例として、悪性腫瘍(がん)が誘導する血管新生が挙げられる。がんはその爆発的な増殖を維持するため、酸素と栄養素の補給を必要としているために、がん細胞自身が血管新生の促進因子を放出して腫瘤部の血管から新たな血管を誘導し、酸素と栄養素、更には転移経路を確保する。腫瘍が誘導する血管は構造的に未熟なことが多く、漏れやすく、血流が滞留しやすい。それゆえ、がん微小環境下では血管新生を促進する要因となる低酸素条件が改善されず、血管新生の恒常性が更に破綻する結果となり、がんの悪性化を促進している。
TGF-βファミリー
Transforming Growth Factor(TGF)-βファミリーの因子はさまざまな生理作用を持つことから、発生や恒常性維持などのさまざまな生理的過程だけでなく、種々の疾患の病因と密接に関与しています。
TGF-βは多くの細胞の増殖を抑制するほか、組織の線維化を促進し、上皮細胞を間葉系細胞に転換させる上皮間葉転換(Epithelial-to-Mesenchymal Transition, EMT)を起こします。このEMTはがん細胞の浸潤・転移を誘導することで、がんの悪性化を引き起こすと考えられています。
骨形成因子(bone morphogenetic protein: BMP)は骨や軟骨の形成を促進することで発見された因子ですが、BMPは無脊椎動物にも存在し、神経や血管、腎臓の形成などに重要な働きを示します。
近年ではiPS細胞の作成においてもTGF-βファミリーの因子が重要な役割を果たしていることが報告され、幹細胞の分化にも重要な役割を果たすことが明らかとなってきました。
TGF-βファミリーの因子の多彩な作用の中でも特に血管・リンパ管新生における役割の研究については近年目覚ましい進展が見られています。腫瘍医科学研究室においては主に、腫瘍血管・リンパ管新生におけるTGF-βファミリーの役割について研究を進めています。
腫瘍微小環境
「がん」というとがん細胞だけがぎっしり詰まっていると考えがちですが、多くのがんではがん細胞のほかに「間質」と呼ばれる部分があって、その間にがん細胞が入っている構造をしています。間質には線維芽細胞と呼ばれる細胞をはじめ、血管やリンパ管そして、これらの細胞の間に存在する結合組織が存在して特徴的な構造を作っており、これを腫瘍微小環境と呼んでいます。
腫瘍微小環境はがん細胞が増殖していく上で重要な「場所」ともいえます。がん細胞を人間に例えるならば、人間が住む「家」が腫瘍微小環境と言えるでしょう。近年では腫瘍をがん細胞のみととらえずに、この腫瘍微小環境をより正確に理解し、新しいがんの診断や治療法の開発に応用しようという考えが世界的に広まってきました。腫瘍医科学研究室では腫瘍微小環境を構成するがん細胞、線維芽細胞、血管、リンパ管を包括的に研究することで、新たな治療法の開発に役立てたいと研究を進めています。
内皮間葉移行(EndMT)
全身に分布する血管は血管内皮細胞からなる管腔から構成されますが、血管内皮細胞はVE-cadherinなどの細胞接着因子からなるアドヘレンス結合とclaudin-5などからなるタイト結合によって緊密な内皮シートを形成しています。
この血管内皮細胞からなるシート構造は安定ではなく、がん微小環境などTGF-βの濃度が高い状況では、内皮間葉移行(Endtohelial-to-Mesenchymal Transition: EndMT)という過程を経て、線維芽細胞などの間葉系細胞へと分化することが近年の研究により解明されています。
血管内皮細胞にTGF-βシグナルが働くと、内皮マーカーの発現は低下し、間葉系のマーカー(SMAαやfibronectinなど)の発現が上昇します。こうしたマーカー分子の発現に伴い、内皮細胞はその接着性を失い、運動性を獲得して間質部分へと浸潤するようになります。
発生の過程におけるEndMTの重要性は心臓の弁形成に異常を示す遺伝子欠損マウスの解析から明らかとなっており、ここではTGF-βとBMPのシグナルが重要な役割を果たすことが報告されています。また、がん微小環境においては、血管内皮細胞からEndMTによって形成された線維芽細胞ががん細胞の増殖や悪性化を亢進することが示されており、腫瘍医科学研究室においては主に、新たながん治療の標的としてEndMTの研究を進めています。
腫瘍溶解性ウイルス療法
ウイルスは本来、人間に病気を引き起こす厄介な存在ですが、その感染増殖力を逆手にとることにより、がんなどの難病を治療するための薬にもなりうるということをご存知ですか?
最近、がんに対する新たな治療法として腫瘍溶解性ウイルス療法が注目されています。これは、がん細胞のみで増殖するように遺伝子を改変したウイルス(腫瘍溶解性ウイルス)を投与することにより、体の正常な部分は傷つけずにがん病巣のみを選択的に破壊することを図るものです。遺伝子改変ウイルスではなく自然変異株が用いられることもあります。すでに日本を含め広く臨床研究が進められています。
ウイルスが細胞内に侵入するためには、ウイルス表面のタンパクが細胞側の受容体に結合することが必要です。腫瘍医科学研究室では、ウイルスが本来の受容体には結合せずに、がん細胞に多く発現する分子のみに結合できるよう遺伝子操作を施すことにより、がん細胞に選択的に感染できる新たな腫瘍溶解性ウイルスの開発に取り組んでいます。
抗体医薬
抗体は、体の中にウイルスや細菌などの異物(自分ではないもの)が侵入した際に作り出されるタンパク質です。ひとつひとつの抗体はそれぞれが対象とする異物の特定の部分(抗原と呼びます)だけを特異的に認識して強く結合し、異物を攻撃・排除する機能をもっています。
がん細胞も一種の異物としてとらえることができます。ウイルスや細菌のように体の外から侵入してくるものとは異なり、がん細胞は体の中からできてくるものですが、もともとは体の中に存在していないという点は同じです。したがって優れた抗体を用いれば、がん細胞も抗体によって攻撃・排除されうるということになります。
現在、がんに対する新薬の開発において最も活発な分野のひとつが抗体医薬です。がん細胞と正常細胞の性質の違いに関する様々な研究成果に基づいた治療戦略が考案されています。たとえば正常細胞に比べてがん細胞の表面に多く存在する分子、あるいはがん細胞の生存・増殖に深く関わっている分子などがターゲット抗原の候補となりえます。すでにいくつかの抗体医薬が実際の医療の現場で使われています。腫瘍医科学研究室では、性能の高い抗体のみを選び出す独自の方法を駆使することにより、新しい抗体医薬の開発に取り組んでいます。
アポトーシス
アポトーシスの特徴と仕組み
生体には不要な細胞や有害な細胞に細胞死を誘導し、これを排除する仕組みが存在します。この細胞死はアポトーシスと呼ばれ、発生や再生過程で生じた不要細胞の排除だけでなく、癌細胞やウイルス感染細胞の排除にも重要な役割を果たしています。アポトーシスは、ほとんどすべての細胞に内在する“自爆装置”が作動することにより起こります。具体的には、細胞にアポトーシスのスイッチが入ると、細胞内に存在するカスパーゼというタンパク分解酵素が活性化され、この活性化されたカスパーゼが、細胞の生存に必須な複数のタンパク分子を分解することにより細胞が死に至ります。アポトーシスを起こした細胞は、いくつかの小さな断片(アポトーシス小体)に分かれ、クロマチンの凝縮等の特徴的な形態を示します。一方で、細胞膜は破れることがなく、細胞の内容物が細胞外へ出ることはありません。また染色体DNAがヌクレオソーム単位で切断されることも大きな特徴です。このDNAの切断にはカスパーゼにより活性化されるDNA分解酵素が関与していることが明らかになっています。
アポトーシスの異常は、様々な疾患の発症や進展に関与していると考えられていますが、その代表的な例は自己免疫疾患です。アポトーシスを誘導するスイッチの1つである、Fasリガンドやその受容体であるFasの遺伝子に異常があるマウスでは、誤って自己の構成成分を攻撃してしまう危険な免疫細胞をアポトーシスにより排除することができず、これらの細胞が異常に増殖して自己の細胞や組織に傷害を与えてしまいます。同様にヒトでも、Fas遺伝子の異常による遺伝性の自己免疫疾患が見つかっています。このようにアポトーシスは、我々が健康に生きていくために必須の現象なのです。
アポトーシスを起こした細胞の行方
生体内では、毎日多くの細胞がアポトーシスにより死んでいますが、その死骸を見つけることは困難です。その理由は、細胞が死ぬとマクロファージ等の食細胞がその死骸をすぐに食べてしまうからです。当然のことですが、マクロファージは生きている細胞は食べず、死んだ細胞のみを食べます。このことはマクロファージが生きた細胞と死んだ細胞を素早く区別できることを意味しています。研究の結果、マクロファージはアポトーシスを起こした細胞表面にのみ存在するフォスファチジルセリンという脂質を認識していることが分かりました。マクロファージがフォスファチジルセリンを認識するために使っている分子も同定されています。この分子がないマウスでは、マクロファージがアポトーシス細胞を食べることができなくなると同時に、自己免疫疾患を発症することが分かりました。危ない細胞にアポトーシスを誘導してその死骸を処理するという一連の流れが、自己免疫疾患の発症を未然に防いでいることが明らかになりました。
細胞の死に方には色々ある?
アポトーシスという言葉は“プログラム細胞死”と同義に使われることが多いです。この“プログラム”とは、1. 発生の過程で死ぬ運命にある細胞が、予定通り(プログラム通り)死ぬという意味と2. 細胞内の自爆装置の作動により死ぬ(自爆プログラムの作動により死ぬ)の2つの意味があるようです。一方、このようなプログラムされた細胞死以外に、熱や物理的な力により細胞が死ぬ場合があり、このような細胞死をネクローシスと呼んでいます。いわば、ネクローシスは“事故死”と考えられているわけです。これまでヒトの細胞には大きく分けてこの2つの細胞死があると考えられてきましたが、最近になって、プログラム細胞死(自爆プログラムの作動により死ぬ)にはアポトーシス以外にも複数の種類があることが分かってきました。これらはネクロプトーシスやパイロトーシスと呼ばれており、これら細胞死の仕組みも明らかになりつつあります。“なぜ色々な死に方が必要なのか”これが現在の細胞死研究の大きなテーマの1つです。
自己免疫疾患
私たちには、病原体の侵入から体を守る免疫システムが備わっています。この免疫システムは、白血球と呼ばれる特殊な細胞集団に支えられています。
自己免疫疾患とは、免疫システムが「守るべき自己」と「排除すべき非自己」をうまく識別できず、自分の細胞を間違って攻撃してしまうために起こる病気です。その原因はさまざまです。家系や人種などの遺伝的背景に、生活習慣が重なることで発症すると考えられています。またほとんどの自己免疫疾患は、若い女性に発症することが知られていますが、その理由はよく分かっていません。
治療には、免疫力そのものを抑える副腎皮質ステロイド製剤や免疫抑制剤が広く使われてきました。また、自己免疫疾患の代表的な病気の一つ、慢性関節リウマチには最近抗TNF抗体が開発され治療に大きな進歩をもたらしました。しかし、免疫力の低下はしばしば重篤な日和見感染症を合併するため、より副作用の少ない治療法の開発が待望されています。
マクロファージ
約100年前、E. メチニコフはヒトデに薔薇のとげを突き刺した時、たくさんの細胞がとげに食いつくのを観察しました。これが「食細胞」の発見です。その後いろいろな動物で研究を続け、大型でアメーバ状の食細胞を「マクロファージ(大食細胞)」と命名しました。
マクロファージは最も原始的な白血球と言われています。例えば、単細胞のアメーバはそれ自身がマクロファージであるといえます。下等な生物である海綿の体にも、マクロファージがあります。このように、ヒトを含む全ての動物がマクロファージを持っているのです。
私たちヒトでは、ほとんどのマクロファージは白血球の一種である「単球」が変化したものと言われています。単球は炎症が起こると、血管から染み出し、「滲出マクロファージ」になります。また、マクロファージは肺、リンパ節、脾臓、骨髄、肝臓、神経、骨、結合組織、皮膚など全身に存在し、「組織マクロファージ」と呼ばれています。
染色体(chromosome)
染色体とは何か、どんな構造をしているのか順を追って説明していきます。
DNAは細くてとても長い
生物は遺伝情報をDNAとして保持しています。DNAは、核酸塩基(4種類)、糖(デオキシリボース)とリン酸からなるデオキシヌクレオチドがつながった2本の長い鎖でできていて、一方の鎖の各塩基がもう一方の鎖の塩基と対(塩基対)をつくることで、お互いに巻き付きながら、らせんを巻いています(二重らせん構造)。DNAの直径は20 Å(2x10-9 m)、長さは1塩基対当たり3.4 Åです。大腸菌のDNAは約460万塩基対なので、その長さは約 1.6 mmになります。ヒトの体細胞のDNAは全体で約64億塩基対なので、長さは約 2 mにもなります。単位が小さ過ぎて分かりにくいので、1万倍に拡大すると、DNAは直径20 μm(2x10-5 m)、つまり髪の毛の約3分の1の太さで、その長さはヒトでは20 kmにもなります。
長い紐を狭い空間に詰め込むには
この長いDNAは、ヒトをはじめとする真核生物では核の中に存在します。ヒトの核の大きさは直径10 μm(1x10-5 m)前後ですので、1万倍すると、直径10 cmになります。このボールの中に、髪の毛よりも細い、長さ2 kmの糸を詰め込むのです。しかも細胞が二つに分裂する前や、必要なタンパク質をつくるためにRNAを合成する時には2本鎖をほどいてやる必要がありますし、勿論途中で切れてしまってはダメです。でたらめに押し込んだら、そんなことは無理です。長い糸は巻き取るのが普通です。同じようにDNAはタンパク質の塊の周りに規則正しく巻きついて、さらにそれが規則正しく折り畳まれていくことで非常にコンパクトに凝集して核内に収められています。このタンパク質と結合したDNAの構造をクロマチン(chromatin)と言います。
クロマチンの基本構造
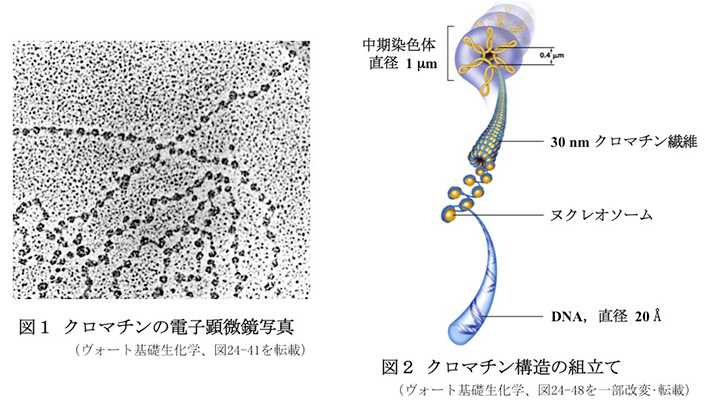
クロマチンを構成している主なタンパク質はヒストンです。ヒストンにはH1, H2A, H2B, H3, H4の5種類があります。一方、クロマチンを電子顕微鏡で観察すると直径約 10 nmの粒子が裸のDNAと思われる細紐でつながり、糸を通したビーズの集まり(あるいは真珠のネックレス)の様に見えます(図1)。この粒子状の構造をヌクレオソームと言います。ヌクレオソームは、ヒストンH2A, H2B, H3, H4が2個ずつ集まって一つの塊をつくり、その周りにDNAが2回弱巻き付いて形成されます。さらにヒストンH1はヌクレオソーム同士を近づける働きを持っていています。ヌクレオソームは直径 10 nmで、約200塩基対のDNA(長さ68 nm)を約8 nmの長さにまで圧縮します。
ヌクレオソームが集まって太い繊維ができる
ヌクレオソーム構造を取ったDNAはさらに折り畳まれて直径 30 nmのらせん状の繊維(30 nm クロマチン繊維)を形成します。30 nmクロマチン繊維の構造としては、ヌクレオソームが単純にらせんを巻いていくモデルと、ジグザグに進みながららせんを巻くモデルとが提唱されています。細胞分裂間期の細胞のDNAは基本的にこの30 nm 繊維構造を取っていると考えられています。
30nm クロマチン繊維は分裂期にさらに凝縮して染色体を形成する
細胞が分裂期に入ると30 nmクロマチン繊維は、コンデンシンとよばれるタンパク質の複合体を足場として、長さ0.6 μmのループを形成していきます。そして足場を中心として放射状にループが多数形成されて光輪の様になり、それが積み重なった構造を取ります。この段階でやっと光学顕微鏡で観察される大きさとなり、染色体とよばれる構造になります(図2)。分裂中期の染色体は生物学の教科書で良く目にするX字型を代表とする形をしています。ヒトは22対の常染色体(計44本)と2本の性染色体(女性はX染色体2本、男性はX戦食滞とY染色体を1本ずつ)の計46本の染色体を持っています。平均的なヒト染色体は、1億4000万塩基対(裸のDNAでは長さ3.4 cm)、直径1 μm、長さ6 μmで、放射状ループを約2000個持つことになります。
DNA複製
自己を複製するということは、生物としての重要な特徴の一つです。細胞は、分裂する際に自らの遺伝情報を担っているDNAを複製して、娘細胞へ伝達します。DNAは4種類のデオキシリボヌクレオチドが重合してできた鎖状のポリマーですが、通常は互いに相補的な構造をもつ2本の鎖が水素結合して、らせん状の構造(2重らせん構造)を取った状態で存在します。この2重らせん構造は適度に安定であり、それぞれの生物が生きている普通の温度では簡単にほどけることはありません。DNAが複製されるときには、ヘリカーゼと呼ばれる酵素の働きで2重らせんがほどかれて1本鎖DNAが露出し、それぞれを鋳型として相補的なDNA鎖がDNAポリメラーゼと呼ばれる酵素によって合成されます。したがって、出来上がった2本鎖DNAは元々あった鋳型鎖と新たに合成された新生鎖とのハイブリッドということになり、このような複製様式を半保存的複製といいます。DNA複製研究の歴史は長く、上述したような基本的な仕組みについては、最初主に大腸菌などの原核生物をモデルとして明らかにされましたが、その後ヒトを含めた真核生物でも共通であることが分かってきました。
一方、研究が進展するにつれ原核生物と真核生物ではDNA複製の制御機構に大きな違いがあることも明らかとなりました。大腸菌は自身の遺伝情報を一つの環状DNAに保持していますが、DNA複製は一カ所の複製起点から開始します。これに対して、真核生物は多数の独立した線状DNAに遺伝情報を分散していて、それぞれの線状DNAについて多数の複製起点から複製開始します。一つの複製起点で複製されるDNA領域をレプリコンと呼びますが、大腸菌は単一レプリコン、真核生物はマルチレプリコンによって複製されるということになります。DNA複製と細胞分裂は上手く連携して起きる必要があるということは容易に想像できます。例えば、全てのDNAが複製を完了していない状態で分裂が起きると、片方の細胞は一部の遺伝情報を失うことになってしまいます(実際、癌細胞などの異常な細胞ではこれに近いことが起きると考えられています)。盛んに増殖を繰り返している状態にある大腸菌では、複製され倍加した環状DNAは均等に分配されますが、そのとき既に次の分裂に備えて複製開始が始まっています。一方、真核生物では、細胞周期(詳細は別項目を参照)のS期で一度だけDNA複製が起きるように厳密に制御されていて、複製されたDNAが分配される時期(M期)とは明確に切り離されています。興味深い例外として、ショウジョウバエの唾液腺などではM期をスキップして、S期が繰り返されるという現象が起こり、通常組織の細胞の数百倍ものDNAを含む巨大な唾液腺染色体として観察されます。
最後に、DNA複製を医科学的な視点から見てみます。紫外線や活性酸素などDNAの構造を変化させる変異源が環境中には多く存在しており、DNAの損傷は頻繁に起きています(別項目を参照)。損傷を受けたDNAが複製の鋳型になったとき、損傷部位で新たな変異が入ったり、複製が停止したり、場合によってはDNAが切断されるなど、より重大なDNAの異常をもたらすことが知られています。正常な細胞にはDNA損傷を修復する様々な仕組みが備わっていて、このような危機的な状況にも対応することが出来ます。しかし、一部の癌細胞ではDNA修復系自体が働きを失っているため、増殖に伴ってどんどん遺伝情報が変化していき、この中からより悪性度の高い癌細胞が生じると考えられています。古くから使われている抗がん剤には、DNA複製を抑制する作用をもつものがよくあります。癌細胞は無限に増殖するという特徴がありますが、DNA複製を抑制すると当然増殖できなくなるため非常に有効です。しかし、正常な細胞の増殖も同様に抑制するので、副作用も大きくなります。また、あえて積極的にDNA損傷を誘導するものを抗がん剤として利用することもあります。正常な細胞では何とか修復して生き延びることが出来るけれども、それを修復できない癌細胞だけが遺伝情報を失って死んでいくというコンセプトですが、同時に、より多くの変異を蓄積した癌細胞が生み出されてしまうというリスクもあります。今後研究が進んでDNA複製や修復の仕組みがさらに詳しく明らかになれば、より効率的に癌細胞だけを選択的に殺すことができるような抗がん剤の開発に繋がると期待できます。
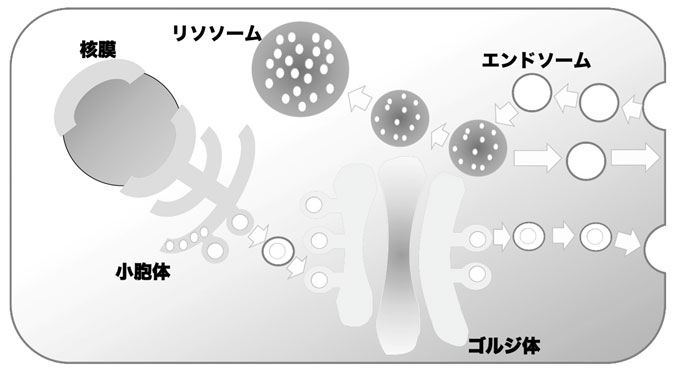
細胞内小胞輸送
真核生物では、細胞内小器官(オルガネラ)の間における物質のやり取りは小さい袋(輸送小胞)により媒介されており、小胞輸送と呼ばれる。あるオルガネラから作られた輸送小胞は、間違えることなく目的のオルガネラまで運ばれて行くが、この過程は多くのタンパク質の機能によりコントロールされている。この「細胞内小胞輸送」という概念を発見したRandy Schekman博士(カリフォルニア大学・バークレー校)、James Rothman博士(Yale大学)、Thomas Südhof 博士らが2013年にノーベル生理学・医学賞を受賞している。
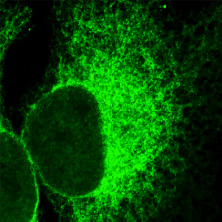 ヒト培養細胞の小胞体(緑色)
ヒト培養細胞の小胞体(緑色)
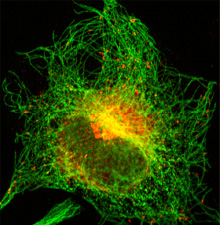 ヒト培養細胞のゴルジ体(中心部の大きな赤色画像;ゴルジ体から出芽した輸送小胞(小さな赤色の点)は微小管(緑色)に沿って細胞膜へと運ばれる。
ヒト培養細胞のゴルジ体(中心部の大きな赤色画像;ゴルジ体から出芽した輸送小胞(小さな赤色の点)は微小管(緑色)に沿って細胞膜へと運ばれる。
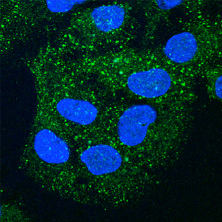 ヒト培養細胞のエンドソーム(緑色)と核(青色)
ヒト培養細胞のエンドソーム(緑色)と核(青色)
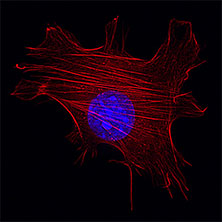 ヒト培養細胞のアクチンフィラメント(赤色)と核(青色)
ヒト培養細胞のアクチンフィラメント(赤色)と核(青色)
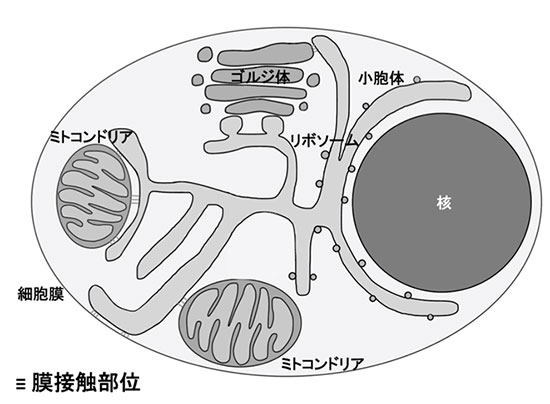
オルガネラコンタクトサイト
オルガネラは、他のオルガネラの一部と膜を通じて物理的に接触しており、その接触する場所(膜接触部位)が細胞の生存に必須となる生理機能をコントロールしていることが近年の研究より明らかになりつつある。膜接触部位では、生命活動において重要となる脂質やイオンの交換が行なわれている。また、オートファジー(細胞が栄養飢餓に陥った際に自身の細胞成分を分解することで栄養を補填する機構;2017年に東京工業大学・大隅良典先生がノーベル生理学・医学賞を受賞)の開始時に形成されるオートファゴソームは小胞体とミトコンドリアが接触している場所より形成されることが明らかにされた。
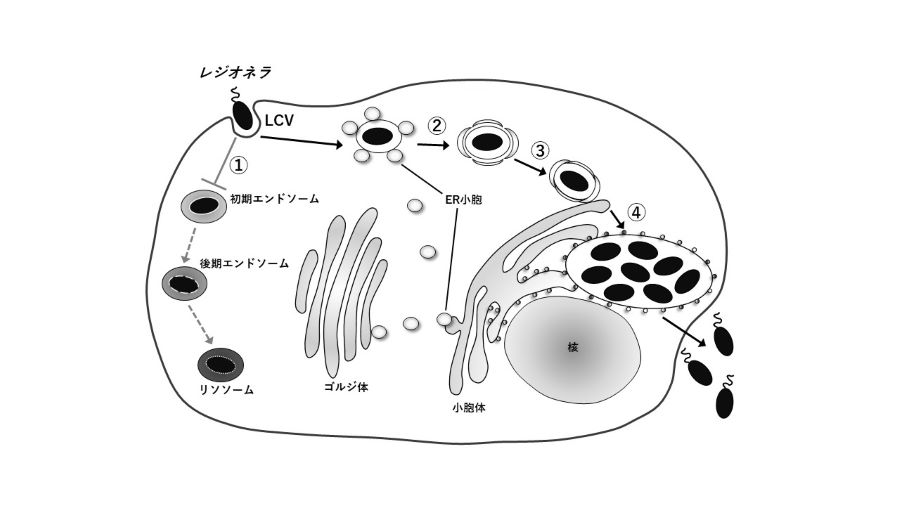
レジオネラ感染
重篤な肺炎を引き起こすレジオネラは、細胞内に侵入した後にLCVと呼ばれる特殊な膜構造を形成します。その後、LCVは宿主細胞に備わっている細胞外の異物を分解する経路から逃れます(図の①)。一方、LCVには宿主細胞の小胞体から出芽した輸送小胞(ER小胞)が供給され、LCV膜の構造変換が起こります(図の②)。この膜構造の変化によって、LCVは小胞体へと到達することができ(図の③)、最終的にレジオネラは小胞体で増殖します(図の④)。増殖後は感染細胞を破壊し、周辺の細胞へと感染を広げていくことで病気を引き起こします。