ニュース&トピックス 染色体導入効率を飛躍的に改善する技術を開発~人工染色体を用いたゲノム合成研究・再生医療研究を加速~|プレスリリース
- 生命科学部
- 研究活動
- プレスリリース
- 応用生命科学科
2023.07.19

プレスリリース
ポイント
- 微小核細胞融合法注1(MMCT法)は人工染色体注2等、数百万塩基対(メガベース Mb)規模の遺伝子情報を染色体受容細胞に導入できますが、導入効率の向上が課題でした。
- 本研究では、従来の微小管重合阻害剤注3コルセミドに替わり、微小管脱重合阻害剤注4タキソールと紡錘体チェックポイント阻害剤注5リバーシンの2剤を用いた新技術を開発し、従来法と比較して約5~18倍の染色体導入効率を達成しました。
- 本技術を用いて、ゲノム合成分野では、Mb規模の遺伝子改変を行うモデル細胞・動物の作製、また、再生医療分野では、遺伝子・細胞医薬品の開発が大幅に加速すると考えられます。
鳥取大学の香月康宏教授、東京薬科大学の宇野愛海助教らの研究グループは、ヒトおよびマウス人工染色体による疾患モデル細胞・動物作製、再生・細胞医薬品の開発を目指しています。しかし、ヒトiPS細胞をはじめ哺乳類細胞へ人工染色体を導入する効率は不十分でした。本研究で、人工染色体を保有するCHO細胞注6をタキソールとリバーシンという2種類の化合物を混合して用いることにより、導入効率を飛躍的に上昇させることに成功しました。
微小核細胞融合(Microcell-mediated chromosome transfer:MMCT)法は、人工染色体を持つ染色体供与細胞への微小核誘導、微小核細胞の分取、そして微小核細胞と染色体受容細胞の融合という3つのステップで行われます。これまでの基礎研究から得た知見を基に、最初の供与細胞に微小核を誘導するステップに着目しました。従来のコルセミドから、タキソールとリバーシンを組み合わせた新規の処理方法に変更することで、飛躍的に微小核形成効率が向上することを明らかにしました(図1)。微小核の誘導効率が上昇した結果、染色体導入効率も上昇し、ヒトiPS細胞を含めた様々な細胞に人工染色体を導入する効率が従来法と比較して約5~18倍程度改善することを示しました。
本研究で開発した染色体導入効率を飛躍的に改善する技術は、合成DNAを搭載した人工染色体を用いたゲノム合成研究や、複数の治療遺伝子を細胞に届ける再生・細胞医薬用ベクター技術の開発を大きく加速させるものと期待されています。
本研究成果は、2023年7月14日(米国東部時間)に米国遺伝子細胞治療学会(American Society of Gene & Cell Therapy:ACGCT)の機関誌の1つである国際科学誌「Molecular Therapy-Nucleic Acids」のオンライン版で公開されました。
研究の背景と経緯
ヒトおよびマウス人工染色体は、MMCT法より、哺乳類細胞から哺乳類細胞へ、あるいはモデル動物へ巨大な遺伝子・複数の遺伝子を導入できる画期的な運び手(ベクター)です。ゲノム合成分野において、本研究グループが世界に先駆けて開発を進めているヒトおよびマウス人工染色体は、任意の遺伝子と、その調節に関わる上流と下流を含めたMb模のゲノム配列を搭載できる革新的な技術として期待されています。一般的に用いられる遺伝子の運び手としてはウイルスベクターやプラスミドベクターが知られていますが、数万塩基対以上の遺伝子サイズの搭載は困難とされており、Mb規模の遺伝情報を取り扱うには、人工染色体を利用する必要があります。
しかしながら、MMCT法には染色体導入効率が低いという問題がありました。MMCT法は、染色体供与細胞への微小管重合阻害剤による微小核形成の誘導、遠心分離による微小核細胞の分取、微小核細胞と染色体受容細胞との融合という3つのステップからなります。本研究グループは、最初のステップである微小核形成の誘導効率が染色体導入効率に関与していると仮説を立てました。本研究では従来法で微小核誘導に使用されるコルセミドとは異なる作用機序を持つ微小管阻害剤や、分裂期停止を阻害する薬剤等、分裂期に作用する化合物を対象として、CHO細胞に高い頻度で微小核形成を誘導できる条件を探索しました。また、見出した薬剤処理条件を用いて、MMCT法による染色体導入効率の改善を試みました。
研究の内容
これまで微小核形成との関連が指摘されたていた複数の微小管阻害剤や分裂期チェックポイント阻害剤、それら薬剤の組み合わせを調査した事前検討によって、代表的な微小管脱重合阻害剤タキソールと紡錘体チェックポイント阻害剤リバーシンを併用する方法を見出しました。また、これらの薬剤処理条件を検討し、CHO細胞の微小核形成頻度を著しく改善する条件を明らかにしました(図2A)。これは、これまでに報告のある微小核形成誘導試薬の中では最も効率が高いと考えられます。微小核誘導が飛躍的に改善した結果として、MMCT法によるCHO細胞(供与細胞)から哺乳類細胞(受容細胞)への染色体導入効率が7.7倍に上昇しました(図2B)。様々な人工染色体(HAC/MAC)を保持する複数種類のCHO細胞株についても同試薬を用いて解析したところ、従来のコルセミドを用いたMMCT法と比較し、タキソールとリバーシンを用いるMMCT法が約5~18倍の染色体導入効率を示すことを明らかにしました。
また本研究では、CHO細胞に対する従来法と新規法の微小核形成メカニズムの違いについても解析を行いました。共焦点顕微鏡注7による解析では、既存の報告と一致して、コルセミド処理では紡錘糸の消失が、タキソール存在下では多極化した紡錘糸の過剰形成がそれぞれ観察されました。また生細胞タイムラプス解析法注8によって、CHO細胞はコルセミドまたはタキソール存在下で紡錘体チェックポイントの活性化とみられる分裂期停止を引き起こしましたが、リバーシンの処理によって分裂期停止を解消し、速やかに間期へ移行することが確認されました。さらに、タキソールとリバーシン処理下のCHO細胞は、細胞質分裂を伴わない短時間の分裂期を経て微小核を形成することが示されました。このように、タキソールとリバーシンを併用することで、CHO細胞の微小核形成を強力に誘導できることが確認されました。
最後に、タキソールとリバーシンまたはコルセミドを用いたMMCT法によってヒト人工多能性幹(iPS)細胞に人工染色体を導入し、効率を比較しました。その結果、タキソールとリバーシンを併用するMMCT法により複数の人工染色体導入クローンが安定して得られ、ヒトiPS細胞への染色体導入効率の改善が示唆されました。新たに人工染色体が導入されたヒトiPS細胞では、特筆すべき染色体異常は見られず、再生・細胞医療等に利用可能な人工染色体を持つiPS細胞が効率よく作製できることが示されました(図3)。
今後の展開
CHO細胞等の一部の細胞株を除く、正常細胞等では微小核形成誘導時に強い細胞死が生じるため、MMCT法における染色体供与細胞としては利用できないとされてきました。本研究成果を活用することで、従来は微小核形成誘導が困難であった細胞株を染色体供与細胞として活用できる可能性があり、染色体導入技術の汎用化が期待されます。
また、本研究成果により、染色体導入が容易になったことから、モデル細胞や動物へのMb単位の遺伝情報の導入や、移植用細胞への複数の治療用遺伝子導入に役立つことが期待されます。例えば、21番染色体(断片)を導入したダウン症疾患患者モデル細胞・動物の作製と疾患研究、デュシェンヌ型筋ジストロフィー症疾患由来多能性幹細胞(iPS細胞等)に正常なジストロフィン遺伝子(2.5Mb)等を搭載したヒト人工染色体(HAC)を導入する遺伝子・細胞移植治療法の開発に応用されると期待されます。
参考図
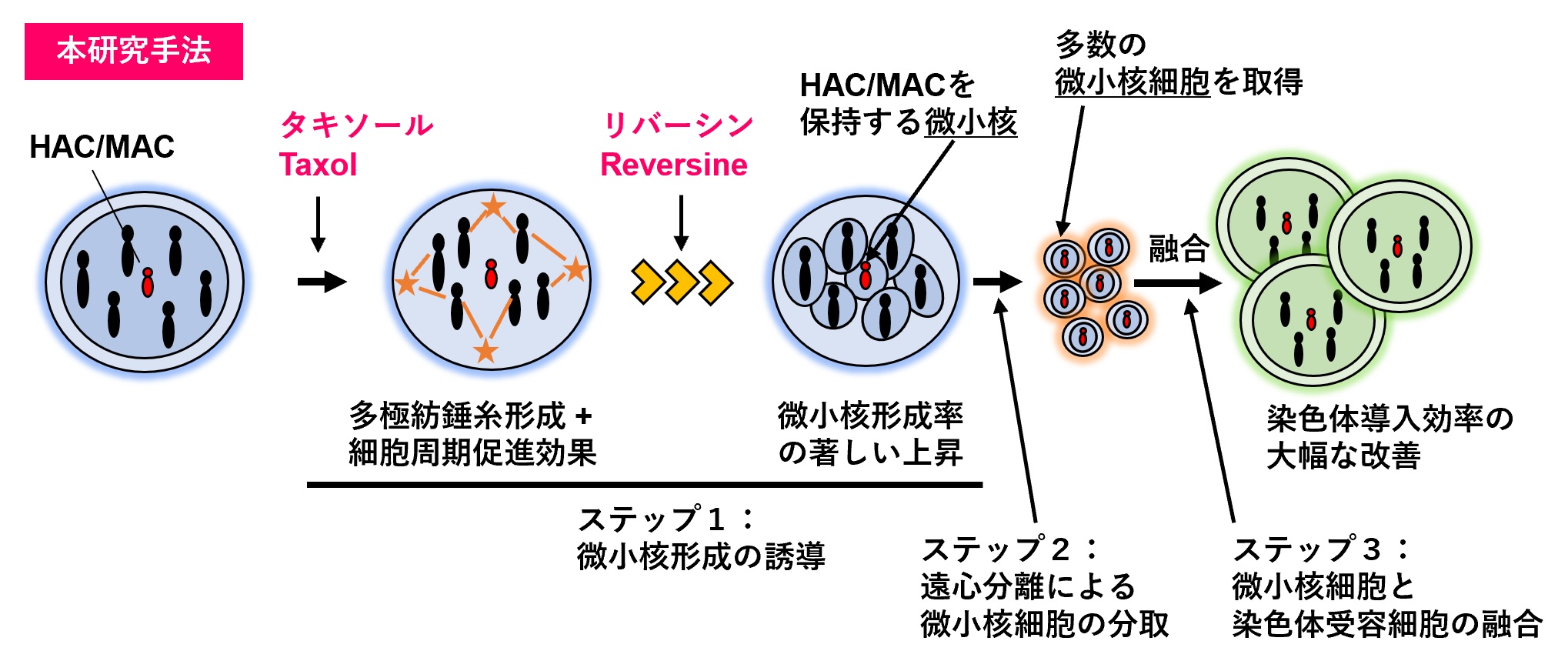 図1 本研究成果概要
図1 本研究成果概要
HAC/MACを含む染色体供与細胞(青色)に対して、微小管脱重合阻害剤タキソールと紡錘体チェックポイント阻害剤リバーシンの2剤を混合して処理することにより、分裂期進行が従来と異なり、ほとんど全ての薬剤処理を受けた染色体供与細胞が微小核を形成しました。結果として、多くのHAC/MACを保持する微小核細胞を獲得可能となり、染色体受容細胞への染色体導入率は大幅に改善した。
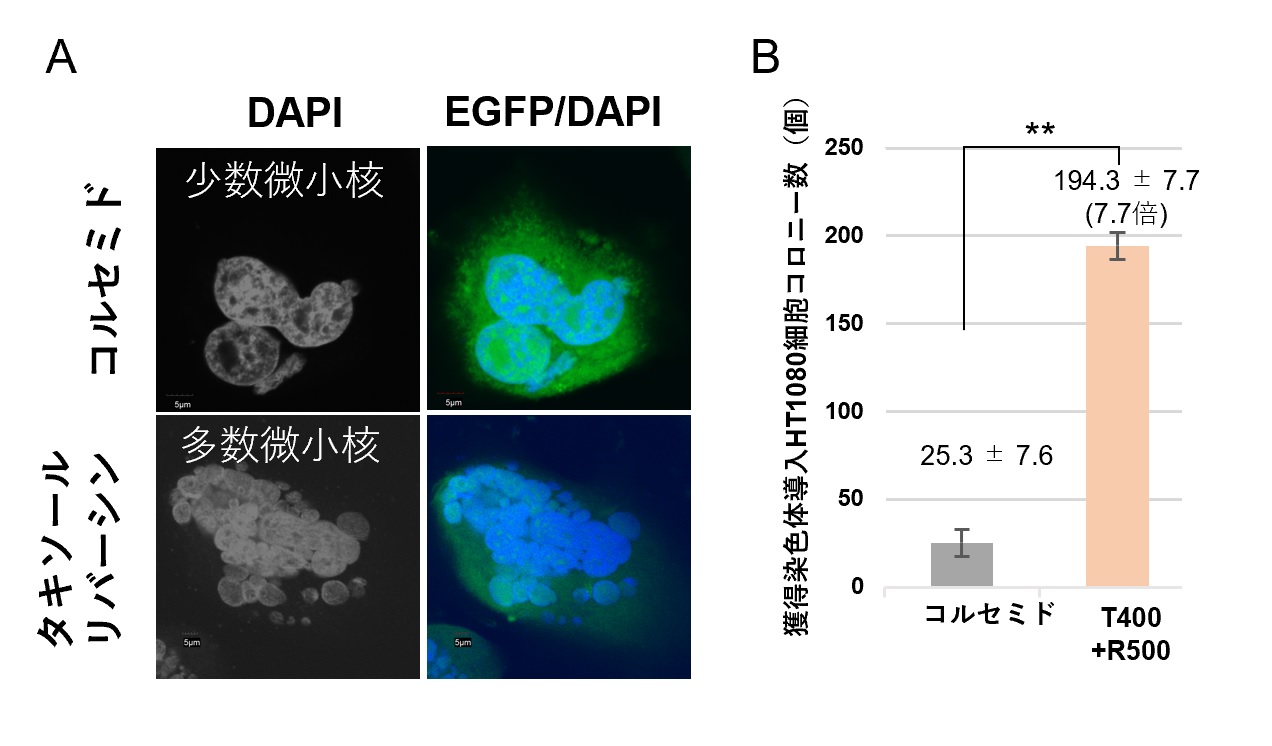 図2 各化合物処理条件での微小核形成像と染色体導入効率の比較
図2 各化合物処理条件での微小核形成像と染色体導入効率の比較
(A) 微小核形成像比較図。DAPI(グレーもしくはブルー)は核を示している。EGFP(グリーン)は細胞質を示している。(B) 各化合物処理条件を用いた際の染色体導入効率検証結果。獲得した薬剤耐性コロニー数で比較して示す。本図では、タキソール(400 nM)及びリバーシン(500 nM)を併用した際のMMCT効率は、従来法(コルセミド)と比較し、7.7倍の効率改善を示した結果を抜粋し掲載した。
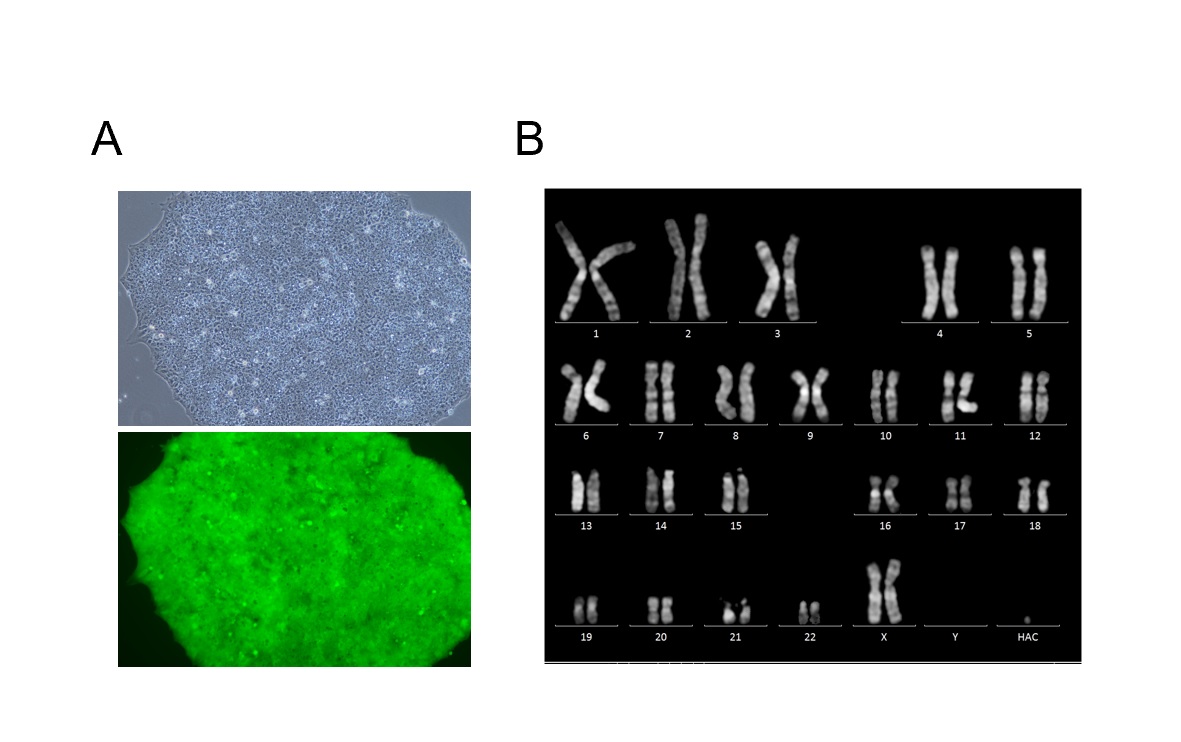 図3 人工染色体導入iPS細胞蛍光顕微鏡写真と核型解析像
図3 人工染色体導入iPS細胞蛍光顕微鏡写真と核型解析像
(A) EGFP遺伝子搭載ヒト人工染色体保持iPS細胞顕微鏡観察像(上段)EGFP蛍光観察像(下段)。(B) 本研究手法によりHACを導入されたヒトiPS細胞の核型解析結果。このヒトiPS細胞は正常核型46,XXに加え、HACを保持することを確認した。
用語解説
-
注1)微小核細胞融合法
MMCT法(Microcell-microcell mediated chromosome transfer)とも呼ばれる、任意の細胞から細胞膜に包まれた微小核(微小核細胞)を取り出し、別の細胞と細胞融合する技術。また微小核とは、染色体の不分離によって生じる、単一または少数の染色体を含んだ核。本研究では人工染色体を保持するCHO(Chinese hamster ovary)細胞の微小核を扱う。 -
注2)人工染色体(Human/mouse artificial chromosome)
天然のヒト21番染色体やマウス10番染色体から染色体維持に必要な部位以外の遺伝子領域を削除し、外来遺伝子導入用の配列を付加させた改変ミニ染色体。
-
注3)微小管重合阻害剤
微小管を構成するチューブリンの重合反応を妨げ、微小管によって構成される紡錘糸の伸長を阻害する薬剤。正常に紡錘糸が染色体に結合しない場合、染色体分配に異常が生じる。
-
注4)微小管脱重合阻害剤
微小管を構成するチューブリンの脱重合反応を妨げ、紡錘糸の短縮を阻害する薬剤。紡錘糸の短縮が阻害されると異常な紡錘体が形成され、染色体分配に異常が生じる。
-
注5)紡錘体チェックポイント阻害剤
紡錘糸と染色体の結合による紡錘体形成の異常を感知して分裂期の停止や細胞死を誘導する仕組みである紡錘体チェックポイントを阻害する薬剤。
-
注6)CHO細胞
Chinese hamster ovary(チャイニーズハムスター卵巣由来上皮由来)細胞株。コルセミド存在化で長期間培養した際に、細胞死を生じにくく、微小核形成を誘導できる哺乳類細胞株である。MMCT法における染色体供与細胞株として、広く用いられる。
-
注7)共焦点顕微鏡
レーザー光にて試料(細胞)を走査して、焦点面でのみ蛍光シグナルを取得することで、高解像度の画像を取得することができる顕微鏡。
-
注8)生細胞タイムラプス解析
生細胞を一定間隔で顕微鏡にてコマ撮りし、複数の静止画像を順番に並べることで、アニメーションのように動画として観察する解析法。
論文タイトル
“Co-treatment of CHO cells with Taxol and reversine improves micronucleation and microcell-mediated chromosome transfer efficiency”
(タキソールとリバーシン併用処理によるCHO細胞における微小核形成誘導効率および微小核細胞融合法を用いた染色体導入効率の改善)
研究支援
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
研究領域:「ゲノムスケールのDNA設計・合成による細胞制御技術の創出」
(研究総括:塩見 春彦 慶應義塾大学 医学部 教授)
研究課題名:「ヒト/マウス人工染色体を用いたゲノムライティングと応用」
研究代表者:香月 康宏(鳥取大学 医学部 生命科学科/染色体工学研究センター 教授)
研究期間:平成30年10月~令和6年3月
また国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム「次世代型ヒト人工染色体ベクターによるCAR交換型高機能再生T細胞治療の開発拠点」、革新的先端研究開発支援事業「免疫系ヒト化動物を活用した抗感染症ヒト抗体創生基盤の確立」、および生命科学・創薬研究支援基盤事業「染色体工学技術を用いたヒト化モデル動物・細胞による創薬支援」などの支援を受けて行われました。
関連リンク
研究に関するお問い合わせ先
- 香月 康宏(カヅキ ヤスヒロ) 鳥取大学 医学部生命科学科/染色体工学研究センター 教授
- 〒683-8503 鳥取県米子市西町86番地
JSTの事業に関すること
- 保田 睦子(ヤスダ ムツコ) 科学技術振興機構 戦略研究推進部ライフイノベーション・グループ
- 〒102-0076 東京都千代田区五番町7 K’s五番町
取材に関するお問い合わせ先
- 鳥取大学 米子地区事務部総務課広報係
- 〒683-8503 鳥取県米子市西町86番地
- 東京薬科大学 総務部 広報課
- 〒192-0392 東京都八王子市堀之内1432の1番地
-
- 042-676-6711(8:45~17:00 月~金、祝日は除く)
- お問い合わせフォーム
- 科学技術振興機構 広報課
- 〒102-8666 東京都千代田区四番町5番地3








