ニュース&トピックス 薬学部の三島正規教授、青山洋史准教授、永江峰幸助教らの研究グループが、光合成を調節する光スイッチの動作するしくみを解明|プレスリリース
- 薬学部
- プレスリリース
- 研究活動
2024.06.13

ポイント
-
光合成を行うシアノバクテリアは、異なる光に応じて最適な光合成ができるよう、光合成に使う光の色を切り替えています。たとえば、一部のシアノバクテリアは、赤い光を使う光合成から緑の光を使う光合成へ、あるいはその逆へと、切り替えることができます。この現象は1世紀以上も前から知られていましたが、どのように緑と赤の光を見分けているのか、詳しいメカニズムはわかっていませんでした。
-
今回、シアノバクテリアが赤い光と緑の光を見分けるために使っている「光スイッチ分子」において、緑の光を感知するときの構造を明らかにしました。同グループが以前に発表した、赤の光を感知するときの構造と比較することで、光スイッチ分子がどのように緑と赤の光を感知しているのかを解明することができました。明らかになったメカニズムは、植物などの他の生物の光スイッチには報告例のない、まったく新しいものでした。
-
この成果は、光合成生物が環境の変化にどのように臨機応変に適応して光合成を行っているのかを解き明かすだけでなく、光によって生物の機能をコントロールするオプトジェネティクス(光遺伝学)のより良いツール作りにもつながると期待されます。
概要
シアノバクテリアは、赤色光と緑色光の存在を感知して、光合成の光をより効率よく吸収するためのアンテナ分子の組成を調節します。
本研究グループは、届く光に応じて自らの構造を変えることで吸収する波長を切り替えるスイッチとしてはたらくタンパク質であるRcaEに着目し、その緑色光吸収状態(Pg)のX線結晶構造の解明に世界で初めて成功しました。RcaEは光を受け取る色素である「ビリン発色団」とそれを取り囲むタンパク質からできています。
以前報告したRcaEの赤色光吸収状態(Pr)との構造の比較により、ビリン発色団の構造が変わるだけでなく、位置も大きくずれ、ビリンを包み込むタンパク質に「水の通り道」の出現・消失を引き起こすことが明らかとなりました。
ビリン発色団の構造をNMR(核磁気共鳴分光法)や量子化学計算と呼ばれる手法で詳細に調べると、緑色光吸収状態では、疎水的な環境に置かれたビリン発色団における特定の部位の水素原子(プロトン)が外れ、それによってビリン発色団の結合状態が変わり、吸収する光の波長が大きく短波長側(赤色主体から緑色主体)へとシフトすることが明らかとなりました。
この解析から、ビリン発色団を取り囲む化学的な性質を親水性と疎水性の間で切り替え、吸収する波長を制御しているという新しいメカニズムの存在を実証することができました。
本研究の成果は、光合成の環境応答のメカニズムの理解への貢献や、光遺伝学などの応用研究の進展への貢献も期待されます。
詳細
シアノバクテリアは、地球の物質循環や生態系に大きな影響を与えることが知られています。シアノバクテリアは多様な環境下で光合成を行うために、光環境の変化に応じて光合成機能を柔軟に調節する能力を進化させてきました。
近年の研究によって、シアノバクテリアはビリン発色団を結合した光受容タンパク質の一群である「シアノバクテリオクロム」を持ち、様々な光の色を感知する能力を持つことが明らかとなりつつあります。特に、緑色光と赤色光を感知するシアノバクテリオクロムRcaEは、光合成アンテナタンパク質のかたちや吸収する光の色を調節する「光スイッチ」としてはたらくことが明らかとなっています(図1)。
この能力は「光色順化」と呼ばれ、光合成生物における環境応答の代表的な例として1世紀以上も前から知られています。本研究グループは以前に、2つの状態をとるRcaEの一方の状態である赤色光吸収状態(Pr)の構造の解明に成功していました(図2)。
しかし、もう一方の緑色光吸収状態(Pg)の構造は明らかになっておらず、光照射によってどのような構造変換が起きているのかは謎に包まれていました。
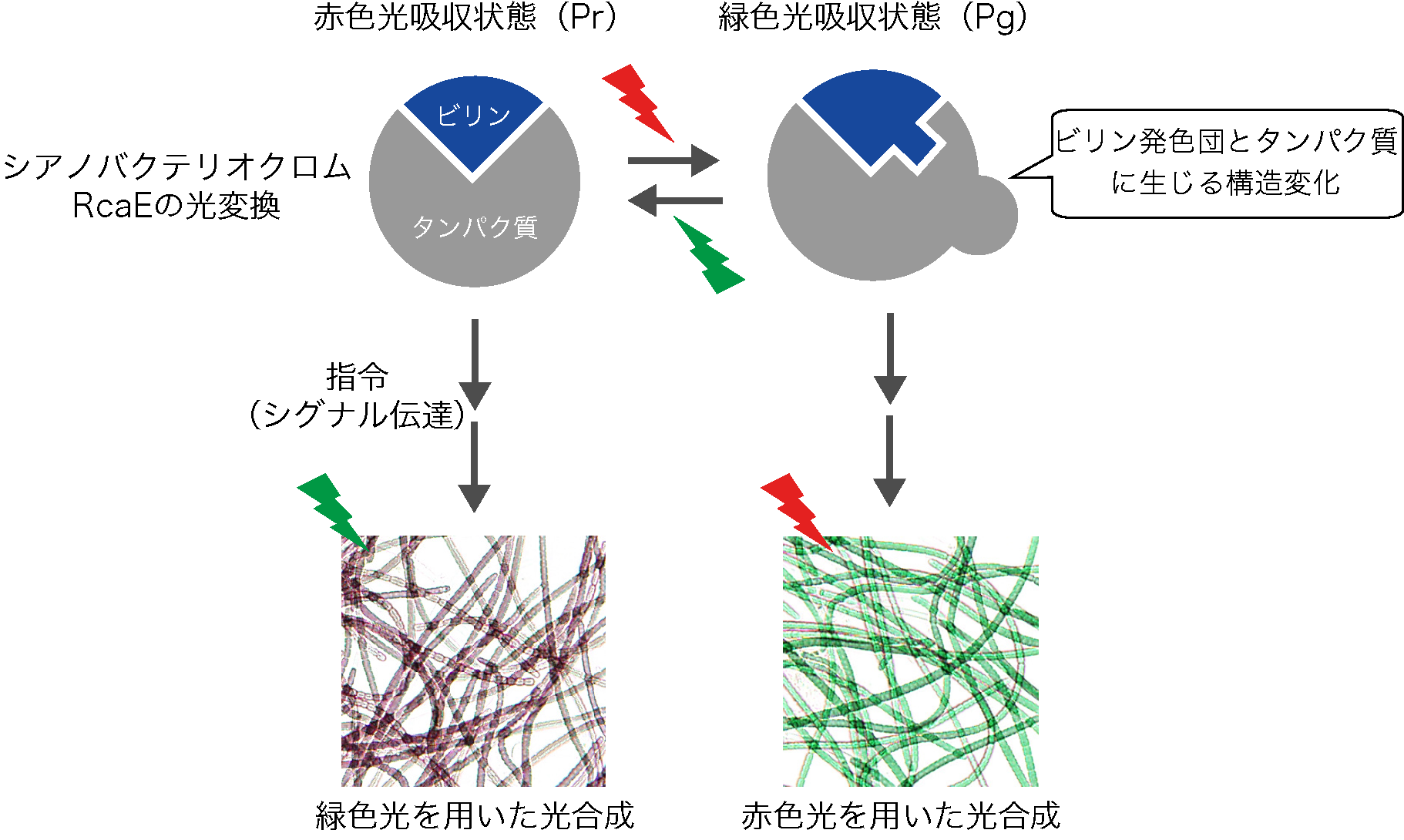 図1:シアノバクテリオクロムRcaEによる光色順化の制御
図1:シアノバクテリオクロムRcaEによる光色順化の制御
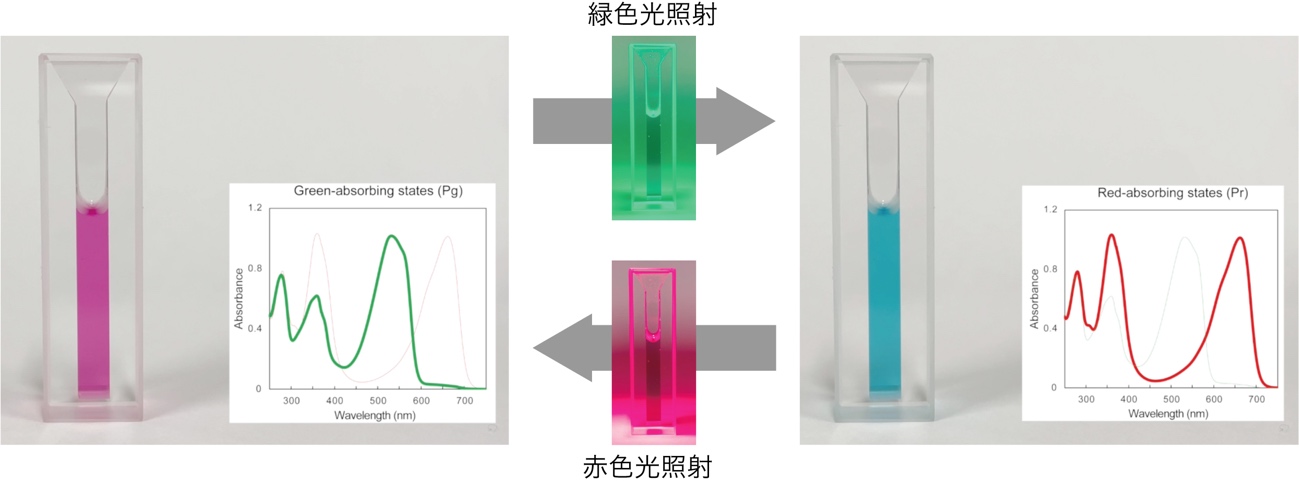 図2: RcaEタンパク質の光変換と吸収スペクトルの変化
図2: RcaEタンパク質の光変換と吸収スペクトルの変化
今回、シアノバクテリオクロムRcaEのPg状態の構造とその詳細の解析に、4つの手法を組みわせたアプローチで挑戦しました。X線結晶構造解析、ビリン発色団の化学合成、NMR測定、量子化学計算です。
これらの解析には国内研究者総勢17名が参画し、豊橋技術科学大学応用化学・生命工学課程 藤田雄也氏、博士前期課程 加茂尊也氏(当時)、濱田雅子技術補佐員、浴俊彦教授、広瀬侑准教授らの研究グループ、東京薬科大学薬学部 永江峰幸助教、青山洋史准教授、三島正規教授らのグループ、佐賀大学理工学部 瀬戸涼香氏、藤澤知績准教授、海野雅司教授らのグループ、金沢大学大学院自然科学研究科物質化学専攻博士前期課程 土田竜也氏(当時)、添田貴宏准教授、宇梶裕教授らのグループ、大阪大学蛋白質研究所 宮ノ入洋平准教授、自治医科大学医学部生理学講座 佐藤文菜講師、東京都立大学大学院理学研究科 伊藤隆教授が協力して研究に取り組みました。
まず、本研究グループはRcaEのPg状態のX線結晶構造解析に取り組みました。
Pr状態では比較的容易に結晶構造が解明できましたが、Pg状態ではなかなかよい結晶が得られず、解析は難航しました。そこで、結晶構造解析に用いるRcaEタンパク質の長さや、精製に使用するタグ配列を詳細に検討することにより、Pg状態の構造を1.75Å(0.175ナノメートル)という高い分解能で解明することに成功しました。
ビリン発色団の化学構造を見ると、ピロール環という構造が4つあり、A環からD環までの名前が付いています。構造が明らかになったPg状態では、ビリン発色団の4つのピロール環のうち、D環が外側を向いた構造(C15-Z,anti)をとっていました(図3)。
このような構造はほかのビリン色素を結合している光受容体でも報告され、ビリン発色団が水分子や、取り囲むタンパク質に含まれる親水性のアミノ酸残基との間で、水素結合をつくることが報告されていました。 しかし、今回明らかとなったRcaEのPg状態では、発色団が疎水性のアミノ酸残基によって取り囲まれ、水分子が排除されていることがわかりました(図3)。
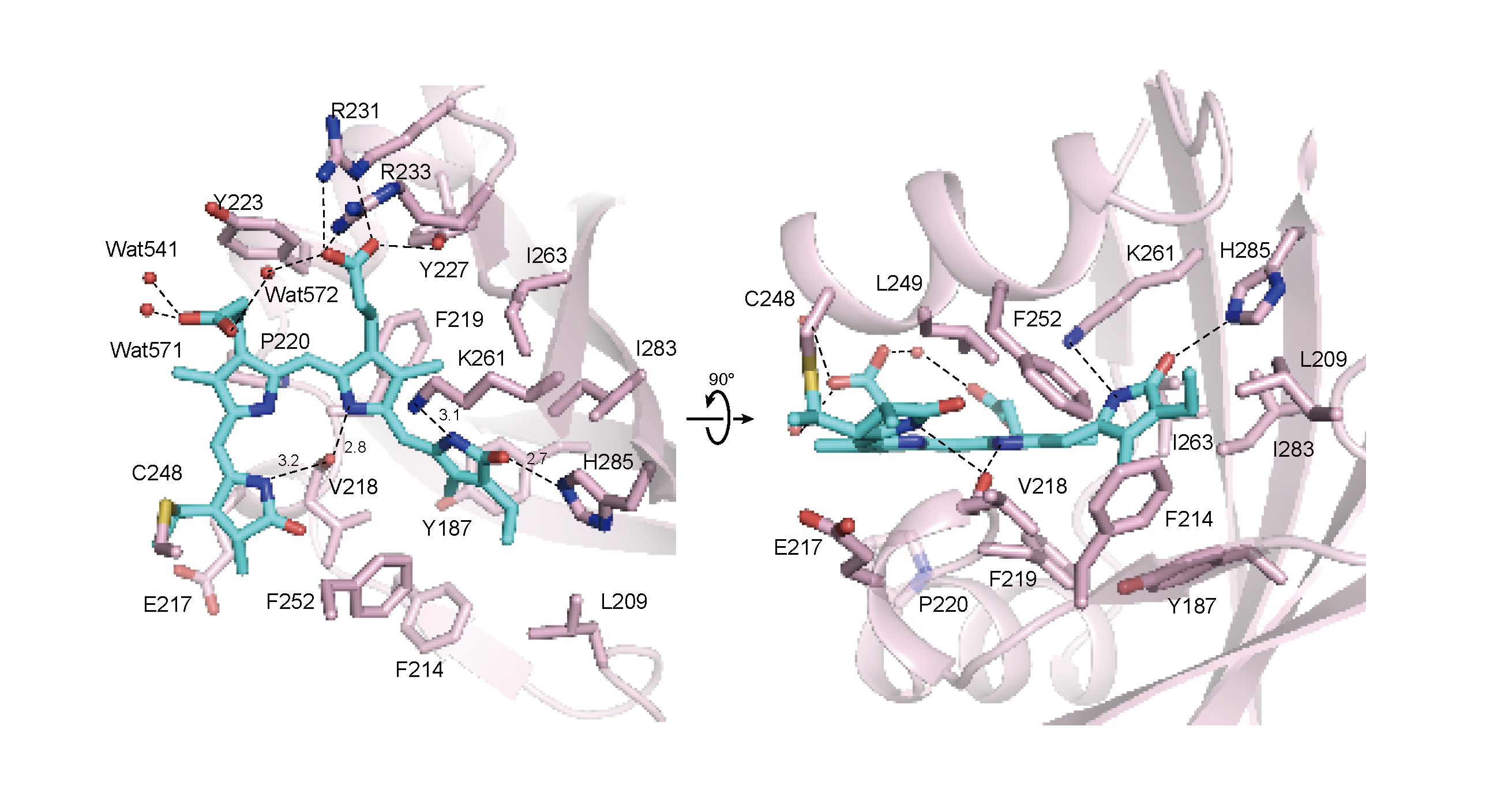 図3:光スイッチタンパク質RcaEの緑色吸収Pg状態の結晶構造
図3:光スイッチタンパク質RcaEの緑色吸収Pg状態の結晶構造
水色で示しているのが光を吸収する色素であるビリン発色団
Pg状態の構造を、以前に解明したPr状態の構造と重ね合わせ、どのような構造変化が起きているかを詳細に解析しました(図4)。
その結果、ビリン発色団のD環が、Pg状態では外側を向いた構造(C15-Z,anti)をとっていますが、Pr状態では内側を向いた構造(C15-E,syn)をとっていることがわかりました。
また、ビリン発色団の位置も大きく回転し、上下方向にもスライドしていました。
この構造変化に伴い、ビリン発色団を取り囲むタンパク質にも大きな構造変化が生じていました。Pg状態では、ビリン発色団の近くにあるタンパク質の部分は構造(S2.5シートとH2.5ヘリックス)がキュッと引き締まり、水分子が入り込む隙間がなくなっています(図4)。
しかし、Pr状態ではこれらの構造が緩んでタンパク質に穴が開き、水分子が入り込んでいました(図4下)。このことは、ビリン発色団を取り巻く環境が疎水的な環境から親水的へと大きく変化することが光変換に重要であることを示しています。
これまでの光受容体の研究の歴史において、ビリン発色団やそれを取り巻くタンパク質にこのような大掛かりな構造変化が生じる報告は今回が初めてです。
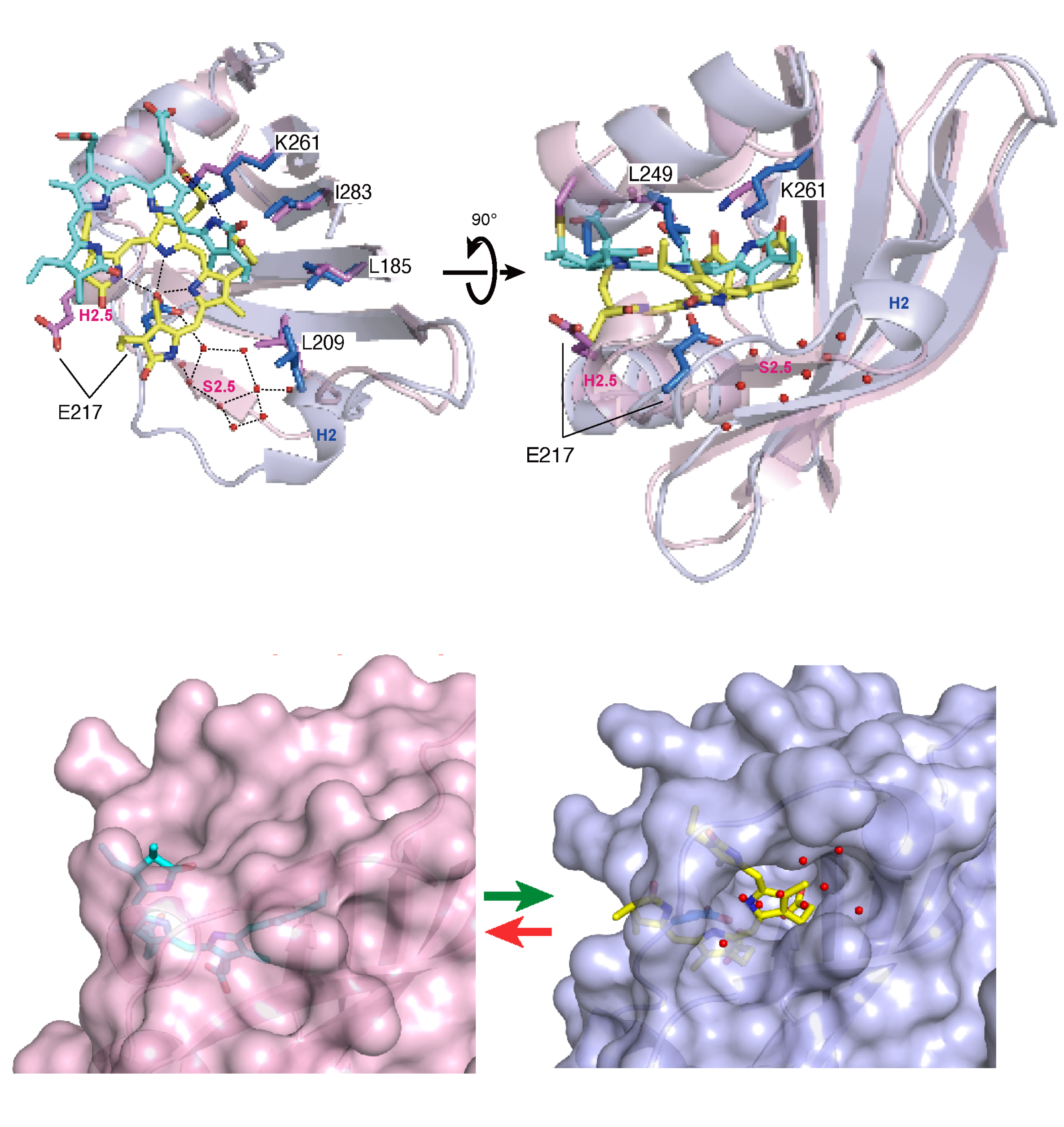 図4: 【上段】Pg状態(ピンク)およびPr状態(青)の結晶構造
図4: 【上段】Pg状態(ピンク)およびPr状態(青)の結晶構造
【下段】Pg状態(ピンク)およびPr状態(青)における水分子の通路の有無
ビリン発色団の吸収波長は、発色団自身の構造の変化や、周囲のアミノ酸残基との相互作用など、多くの因子によって制御されています。本研究グループの以前のRcaEの研究で、ビリン発色団の4つのピロール環(A~D環)において、Pr状態ではすべてのピロール環の窒素原子にプロトンが結合していることを報告しました。
一方、Pg状態ではそのうちの1つのプロトンが外れることを見出しましたが、どの部位で外れているかは明らかではありません。X線結晶構造解析では結合したプロトンを観測できないからです。
そこで本研究グループは、化学合成とNMRを使った研究に挑むことにしました。
ビリン発色団のピロール環の窒素原子を、目印となる安定同位体窒素原子(15N)でラベリングし、そのプロトンの結合状態を1D NMRによって検出する方法を採用しました。ビリン発色団の化学合成という難易度の高い手法を用いて、B環のみ、C環のみに目印をつけたビリン発色団を数年かけて調製し、得られたわずか1回分の試料を用いて渾身の実験を行いました。すると、B環をラベルした試料において、プロトンが外れたシグナルが検出され、対照であるC環をラベルした試料においては検出されませんでした(図5)。
このことから、プロトンが外れる位置(脱プロトン化した位置)はB環であるということが証明されました。
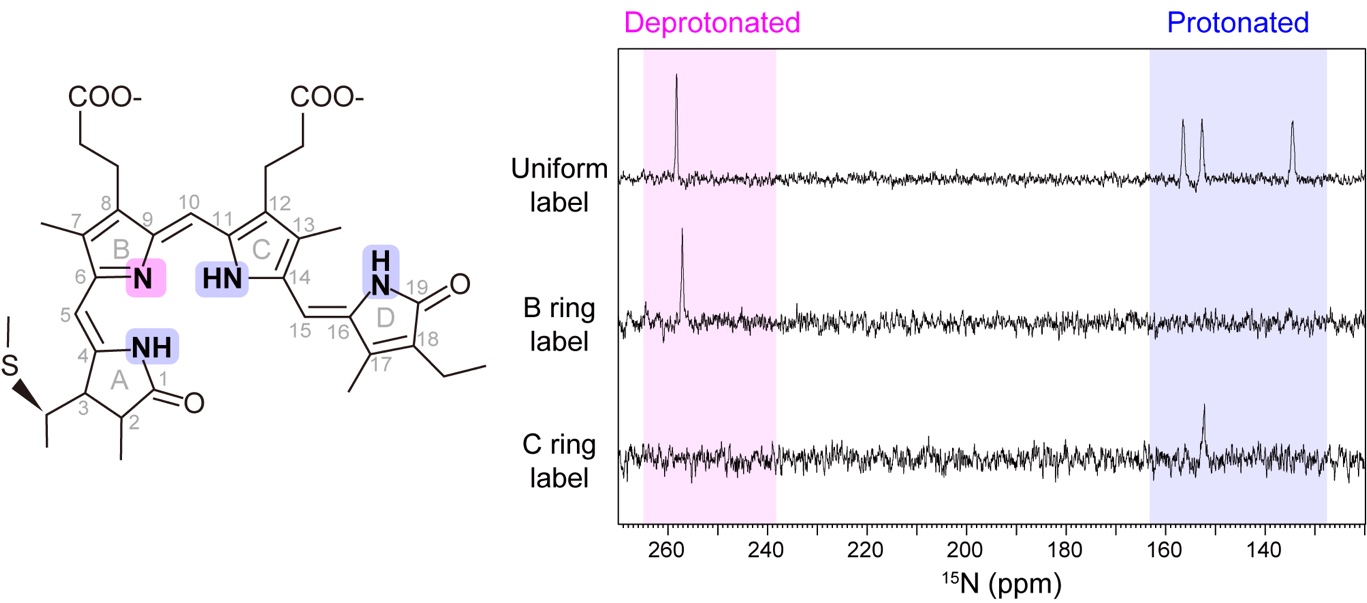 図5:ビリン発色団におけるプロトンが外れる部位(左)と1D 15N NMR測定結果(右)
図5:ビリン発色団におけるプロトンが外れる部位(左)と1D 15N NMR測定結果(右)
ビリン発色団の吸収波長のメカニズムとして、4つのピロール環の配置が平面に近いほど、赤っぽい長波長の光を吸収することが、これまでの研究で明らかとなっていました。今回のPg状態ではビリン発色団4つのピロール環の平面性は大きく崩れておらず、新しいメカニズムが存在すると考えられました。
そこで本研究グループは、今回得られたX線結晶構造と量子化学計算という手法を用いて、B環からプロトンが外れることの影響を詳しく調べました。
その結果、脱プロトン化したB環では、環を構成している炭素原子同士の結合距離にバラツキが生じていることが明らかとなりました(図6)。炭素原子の結合距離のバラツキは、ピロール環におけるπ電子の共有がしにくくなっている(非局在化が弱まっている)ことを示しています。
つまり、Pgではビリン発色団のピロール環の平面性は保ったままで、脱プロトン化という新しいメカニズムによって、吸収波長を大きくシフトさせていることが明らかとなったのです。
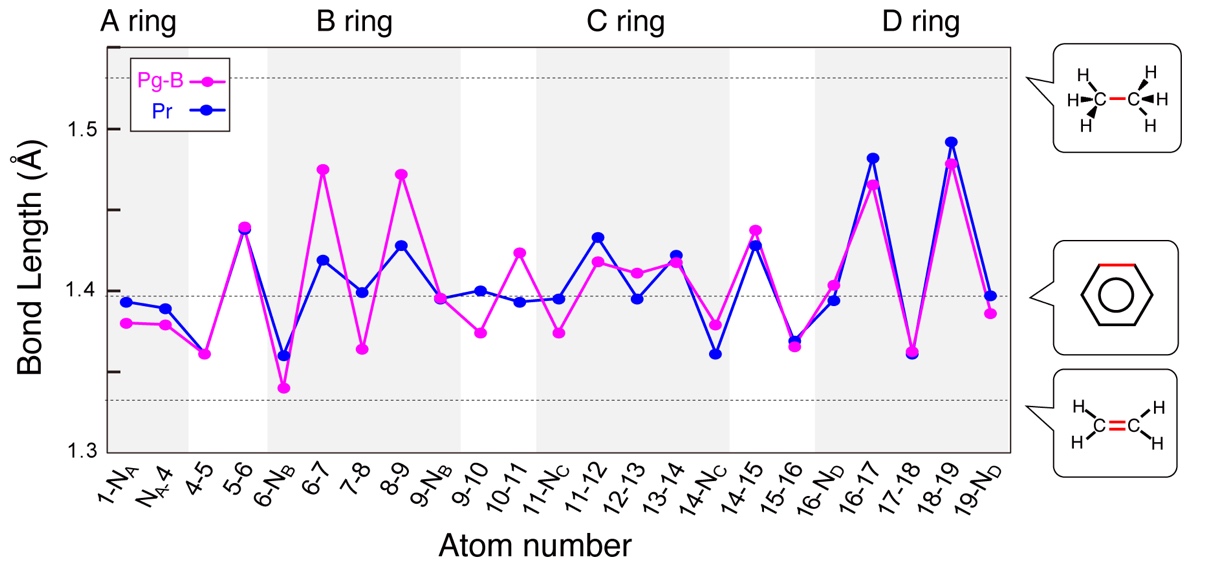 図6:量子化学計算によるPg状態(ピンク)とPr状態(青)の発色団の炭素および窒素の原子間距離
図6:量子化学計算によるPg状態(ピンク)とPr状態(青)の発色団の炭素および窒素の原子間距離
今後の展望
本研究グループのこれまでの研究で、光色順化を制御するシアノバクテリオクロムRcaEのPg状態とPr状態の詳細な構造が明らかとなりました。今後は、Pg → PrとPr → Pgの光によって変換していく過程で、どのような中間状態が生じているのか、その詳細なメカニズムに迫っていくことが重要です。そのためには、低温ラマンスペクトルや過渡吸収スペクトルといった各種の分光解析と、発色団の同位体ラベリング、量子化学計算といったアプローチを組み合わせた融合型の基礎研究を推進する必要があります。
また、緑・赤色光を吸収するタイプのシアノバクテリオクロムは、光照射によって生物の遺伝子機能を操作する光スイッチとしての利用が進んでいます。オプトジェネティクスと呼ばれるこの技術は研究ツールとして、特に脳神経系の基礎研究分野で大いに役立っています。
今回の発見を応用し、ビリン発色団のプロトン化状態を制御することが可能になれば、光スイッチの吸収波長を大きく改変できると考えられます。その結果、様々な波長の光を用いて、生物の機能を自在に調節できる未来がやってくるかもしれません。
論文情報
論文タイトル:Green/red light-sensing mechanism in the chromatic acclimation photosensor
著者名:Takayuki Nagae, Yuya Fujita, Tatsuya Tsuchida, Takanari Kamo, Ryoka Seto, Masako Hamada, Hiroshi Aoyama, Ayana Sato-Tomita, Tomotsumi Fujisawa, Toshihiko Eki, Yohei Miyanoiri, Yutaka Ito, Takahiro Soeta, Yutaka Ukaji, Masashi Unno, Masaki Mishima1, and Yuu Hirose
雑誌:Science Advances
掲載日:2024年6月12日(水)14:00(午後2:00)(米国東部時間)
謝辞
本研究は、文部科学省科研費基盤研究(21K04997,23H04962, 22H02562, 22K05037)、文部科学省先端研究基盤共用促進事業、あいちシンクロトロン光センター、公益財団法人日揮・実吉奨学会研究助成、公益財団法人立松財団研究助成、一般財団法人イオン工学振興財団研究助成による支援を受けて行われました。
光合成を調節する光スイッチの動作するしくみを解明|プレスリリース
取材に関するお問い合わせ先
- 東京薬科大学 入試・広報センター 広報担当
-
- 042-676-4921(8:45~17:00 月~金、祝日は除く)
- お問い合わせフォーム
研究に関するお問い合わせ先
- 東京薬科大学 薬学部 分子生物物理学教室 教授 三島 正規









