ニュース&トピックス 胎児脳の発生に必須な神経移動機構を解明 ~自閉症など発達障害の新たな治療法の開発に期待~|プレスリリース
- 生命科学部
- SDGs
- 生命医科学科
- 研究活動
2021.07.27
プレスリリース
胎児脳の発生に必須な神経移動機構を解明~自閉症など発達障害の新たな治療法の開発に期待~
- ポイント
-
- 胎児脳の神経細胞移動の破綻は自閉症などの発達障害の原因になるが詳細な制御機構は不明である
- 発達障害関連タンパク質CAMDIは神経細胞の移動時に特徴的な構造形成に関与する
- 特徴的な構造の中でCAMDIは安定と分解を周期的に繰り返す
- CAMDIの安定と分解の周期的な繰り返しを消失させると神経細胞移動が異常になる
- CAMDIの安定性の制御を標的とした自閉症などの治療法の確立へ道を拓くことが期待される
概要
自閉症などの発達障害や統合失調症などの精神疾患の研究は、社会的な要請もあり重要な研究課題となっています。発症要因の1つとして胎児期の神経細胞の移動が異常になることが知られていましたが、その詳細な分子機構は不明でした。
この度、東京薬科大学生命科学部の福田敏史講師のグループは、発達障害の発症と関連するタンパク質CAMDIがマウスの胎児脳においてどのように機能しているかを解析しました。その結果、CAMDIの発現を阻害した神経細胞では、移動する際にその進行方向に形成されるダイレーションと呼ばれる膨らみが消失することを明らかにしました。神経細胞は、尺取り虫の様に突起を伸ばして細胞を移動する、というサイクルを繰り返して目的の位置まで移動します。そこで脳組織を生きたまま解析するライブイメージングを行ったところ、CAMDIはダイレーションにおいて安定と分解が繰り返されること、CAMDIが安定している間に神経細胞が移動していることを見出しました。また、神経細胞は細胞分裂を終了した細胞ですが、CAMDIは細胞分裂に必要な機構によって分解されること、その分解を止めると次のサイクルに進めずに神経細胞が移動できないことが明らかになりました。これらの結果は、安定と分解を周期的に繰り返すタンパク質が胎児期の神経細胞の移動を制御していることを示した成果であり、神経細胞の移動制御を標的とした自閉症など発達障害の治療法の確立に道を拓くことが期待されます。
発表雑誌
雑誌名:Journal of Biological Chemistry
論文名:Oscillation of Cdc20-APC/C-mediated CAMDI stability is critical for cortical neuron migration
https://www.jbc.org/article/S0021-9258(21)00788-2/fulltext#relatedArticles
研究背景・経緯
精神疾患とは、生まれながらの心や脳の特性(個性)が日常生活に支障をきたす疾患です。代表例として統合失調症や自閉症、注意欠陥多動性障害、学習障害等の発達障害が含まれています。近年、大人になってから発覚する発達障害として適応障害や引きこもり等が社会的な問題となっています。
社会性などの高次機能を担う大脳皮質は胎児期(お母さんのお腹のなかにいる間)に形成が行われます。大脳皮質を形成する部位では、脳の内側に存在する神経幹細胞が非対称分裂することにより神経細胞が生み出されます。その神経細胞は脳の外側へ向かって移動をすることで将来の大脳皮質に認められる6層構造を形成します。神経細胞の移動の際には進行方向にダイレーションと呼ばれる膨らみが形成され、そこに中心体が先行して移動し、その後に核が移動することで細胞全体を移動させます。その後、ダイレーションが消失することで次の移動サイクルに進むという一連の動きを周期的に繰り返すことで細胞移動が行われます。これまでに、ダイレーション形成が神経細胞の移動に重要であることは知られていましたが、周期的にダイレーションの形成と消失を繰り返す分子機構は明らかではありませんでした。
私たちは精神疾患関連蛋白質DISC1に結合する新規蛋白質を発見し、CAMDI (Coiled-coil protein Associated with Myosin IIa and DISC1)と名付けました(Fukuda et al. J. Biol. Chem. 2010)。胎生期の大脳皮質で発現が認められ、細胞内では中心体で局在が認められること、発現阻害により大脳皮質神経細胞の移動異常を示すことを明らかにしました。また、CAMDI遺伝子は染色体上の自閉症の原因領域の一つである2q31.2に存在します。そこでCAMDIの欠損マウスを作成したところ、神経細胞移動の遅延、HDAC6の過剰活性化を伴う中心体の未成熟に加えて自閉症様の行動を示しました。さらに胎生期にHDAC6特異的阻害剤の投与を行ったところ、神経細胞移動の遅延が回復し自閉症様行動が改善しました(Fukuda et al. EMBO Rep. 2016)。自閉症様行動の原因の1つとしてCAMDI遺伝子が制御する神経細胞の移動異常であることが示唆されましたので、その詳細な分子機構を明らかにすることを目的としました。
研究内容
本研究では、CAMDIが神経細胞の移動中の「いつ」「どこで」「どの様な」振る舞いをするかを詳細に解析することで、自閉症を含む発達障害の原因の1つである神経細胞移動の分子機構を解明することを目的としました。神経細胞の移動は進行方向に突起を伸ばしダイレーションと呼ばれる膨らみを形成し、ダイレーションに中心体が侵入した後に細胞体を引き寄せて移動するというステップを繰り返して大脳皮質を形成します。まず、移動中の神経細胞の中でCAMDIの局在を解析しました。ダイレーション形成前の神経細胞では、進行方向後端の細胞体を押し上げる領域に多く局在していました。ダイレーションが形成されると、CAMDIはダイレーションと中心体の周囲に局在を変化させることが明らかとなりました。また、CAMDIの発現を阻害した神経細胞ではダイレーションの形成が大幅に阻害され、さらに神経細胞の移動速度が約25%程度まで減少することを見出しました。
次に、生体内で目的タンパク質を光らせるためにCAMDI遺伝子とEGFP遺伝子を融合させてマウスの胎児脳に導入後、生きたままの脳組織を薄くスライスして蛍光顕微鏡下で継時的に解析しました(ライブイメージング)。EGFP遺伝子のみを導入した神経細胞は、移動サイクルの間でEGFPのシグナルの輝度は変化しませんでした。一方、EGFP-CAMDIのシグナルは進行方向に伸ばした突起中に形成されるダイレーションと中心体の周囲に認められること、その両シグナルが一体となってCAMDIが安定化して輝度が最高に達すると細胞体が引き上げられることが明らかとなりました。その後CAMDIの輝度は急速に減少すること、再びCAMDIのシグナルが安定化すると次の移動サイクルへ移行することを見出しました。
EGFP-CAMDIの輝度が増減する分子メカニズムの解析を行ったところ、細胞分裂が終了している神経細胞にも関わらず、細胞分裂(G2/M期)の制御因子であるCdc20-APC/Cによってユビキチン化されて分解されていることが明らかとなりました。CAMDIはCdc20と中心体に共局在して分解制御を受けていること、CAMDIとCdc20の結合部分を破壊した変異を導入したCAMDIはユビキチン化を受けず分解されなくなることを見出しました。さらに、APC/Cの阻害剤であるApcinの処理やCAMDIとCdc20の結合部分を破壊した変異させたCAMDI遺伝子を神経細胞に導入してライブイメージング解析をすると、ダイレーション形成やCAMDIの輝度変化が消失し、神経細胞の移動が阻害されることが明らかとなりました。これらの結果から、移動中の神経細胞の中でCAMDIが適切な時期に適切な発現量であり、さらにその安定と分解の繰り返しが周期的に行われることが胎児脳の形成に重要であることが明らかとなりました。
今後の展開
胎児脳の神経細胞移動における周期的な分子メカニズムの制御を標的とした自閉症を含む発達障害の新たな治療法の確立が期待されます。
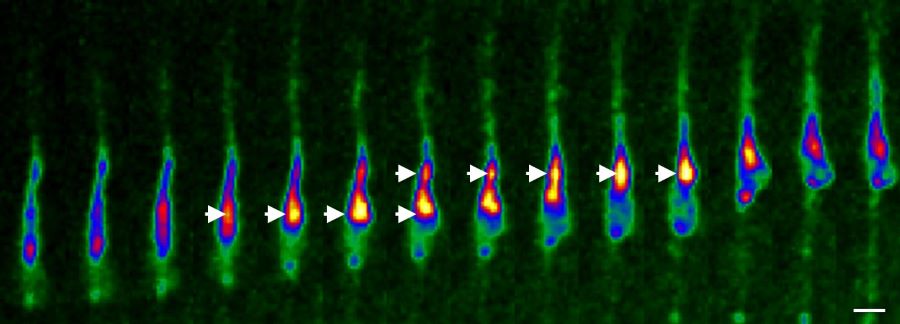 図1 CAMDIは周期的に安定と分解を繰り返す
図1 CAMDIは周期的に安定と分解を繰り返す
移動中の神経細胞にEGFP-CAMDIを導入し、脳組織が生きたまま解析を行った。赤〜黄色の領域がEGFP-CAMDI発現量の多い場所を示す。CAMDIはダイレーション(上の矢頭)と中心体(下の矢頭)で発現量が増えて、その両者が合わさることで神経細胞が画面上へと移動している。その後再びCAMDIの発現量が減少する。 この工程を繰り返すことが正常な大脳の神経細胞の移動や構造形成に必須であることが明らかとなった。
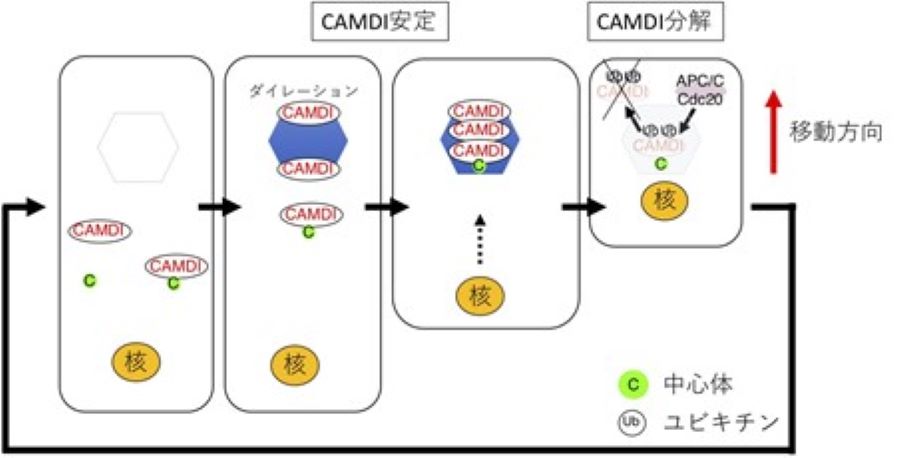 図2 CAMDIによる神経細胞移動の分子メカニズム
図2 CAMDIによる神経細胞移動の分子メカニズム
(一番左)CAMDIが少しずつ安定化される
(左から2番目)ダイレーションと中心体にCAMDIが集積し始める
(左から3番目)ダイレーションに中心体が侵入するとCAMDIの集積が最高潮に達し、神経細胞が移動する
(一番右)移動が完了するとCAMDIはCdc20-APC/Cにより分解され、次の移動サイクルへと進む
関連リンク
【取材に関するお問い合わせ先】
- 東京薬科大学 総務部 広報課
-
- 042-676-6711(8:45~17:00 月~金、祝日は除く)
- お問い合わせフォーム
【研究に関するお問い合わせ先】
- 東京薬科大学 生命科学部 再生医科学研究室 講師 福田敏史
-
- 042-676-5136
- tfukuda@toyaku.ac.jp








