ニュース&トピックス 細胞膜の張力ががんの浸潤・転移を抑制する -- 細胞の物理特性を標的としたがん治療への期待|プレスリリース
- 生命科学部
- SDGs
- 生命医科学科
- 研究活動
2021.10.13

プレスリリース
細胞膜の張力ががんの浸潤・転移を抑制する -- 細胞の物理特性を標的としたがん治療への期待
神戸大学バイオシグナル総合研究センターの辻田和也講師、伊藤俊樹教授と、東京薬科大学の佐藤礼子講師、深見希代子名誉教授らの研究グループは、がん細胞の細胞膜が正常細胞と比較して柔らかいこと、また、細胞膜を硬く操作することにより、マウスモデルにおいて、浸潤・転移を抑制できることを発見しました。今後、がん細胞の物理特性を標的とした新しいがん治療への応用が期待されます。この研究成果は、10月11日に、Nature Communicationsに掲載されました。
- ポイント
-
- がん細胞の細胞膜は正常細胞と比べて柔らかい
- がん細胞の細胞膜が硬くなるように操作すると、マウスモデルにおける浸潤・転移を抑制できた
- がん細胞の物理特性を標的とした新しいがん治療への応用に期待される
研究の背景
がんの浸潤・転移はがん患者の命を奪う大きな原因です。がん細胞は、悪性度が増すと、アメーバのように細胞形態を変幻自在に変えながら運動できるようになり、原発巣から離れて遠隔転移を引き起こします。近年の研究により、このような細胞形態の大きな変化と運動性は、細胞自体の物理的な性質により制御されることが明らかになってきました。実際に、がん細胞は正常細胞と比較して「柔らかい」ことが報告されており、細胞の物理的性質の変化とがん化の関係性が注目されています。しかしながら、がん化と関係する細胞の物理特性については不明となっていました。
研究の内容
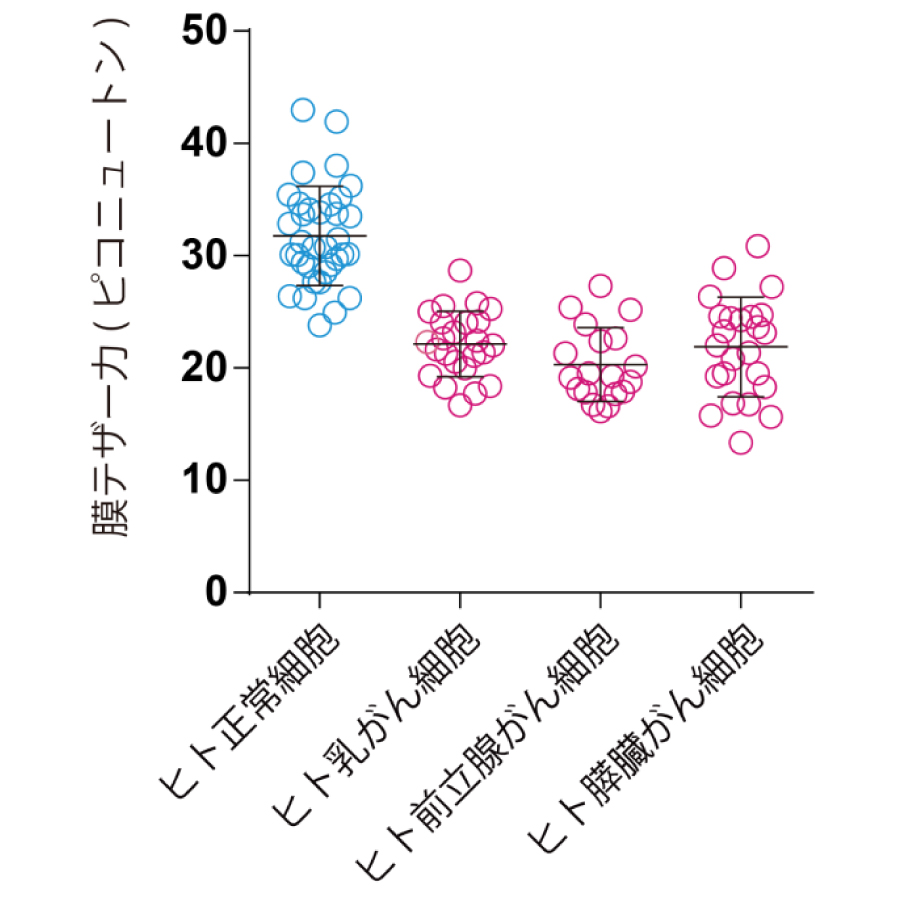 図1. がん細胞の細胞膜の硬さは減少している
図1. がん細胞の細胞膜の硬さは減少している
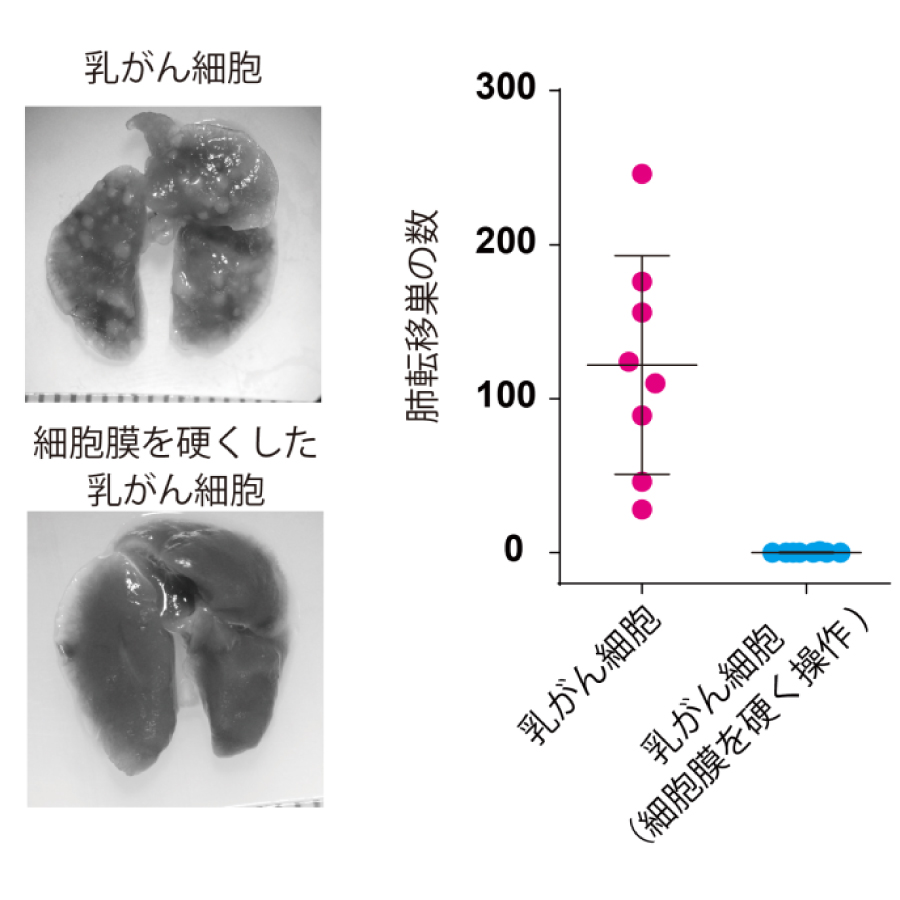 図2. 細胞膜を硬くするとマウスモデルにおける転移が抑制される
図2. 細胞膜を硬くするとマウスモデルにおける転移が抑制される
今回、辻田らは、光ピンセット※を用いて、細胞表面の膜を引っ張って解析した結果、がん細胞の細胞膜が正常細胞と比較して柔らかいことを突き止めました(図1)。細胞膜の硬さは、細胞膜と膜直下にあるアクチン細胞骨格タンパク質との接着により制御されます。今回の研究により、がん細胞では、この接着構造を維持するERMタンパク質が細胞膜から外れて、細胞膜が柔らかくなっていることが分かりました。そこで、ERMタンパク質をがん細胞の細胞膜に強制的に付着させて、この接着構造を正常細胞のように「回復」させたところ、がん細胞の細胞膜が硬くなり、細胞形態の異常な変化や運動性が抑えられました。さらに、この膜が硬い乳がん細胞は、マウスモデルにおける肺への転移能を消失していました(図2)。これらの結果から、細胞膜を硬く操作することで、がんの転移を抑制できる可能性が考えられました。
今後の展開
細胞膜を硬くする化合物が見つかれば、がんの浸潤・転移に効果的な薬として利用できるかもしれません。今回の研究により、がん細胞の物理特性を標的とした新しいがん治療の開発につながる可能性が考えられます。
用語解説
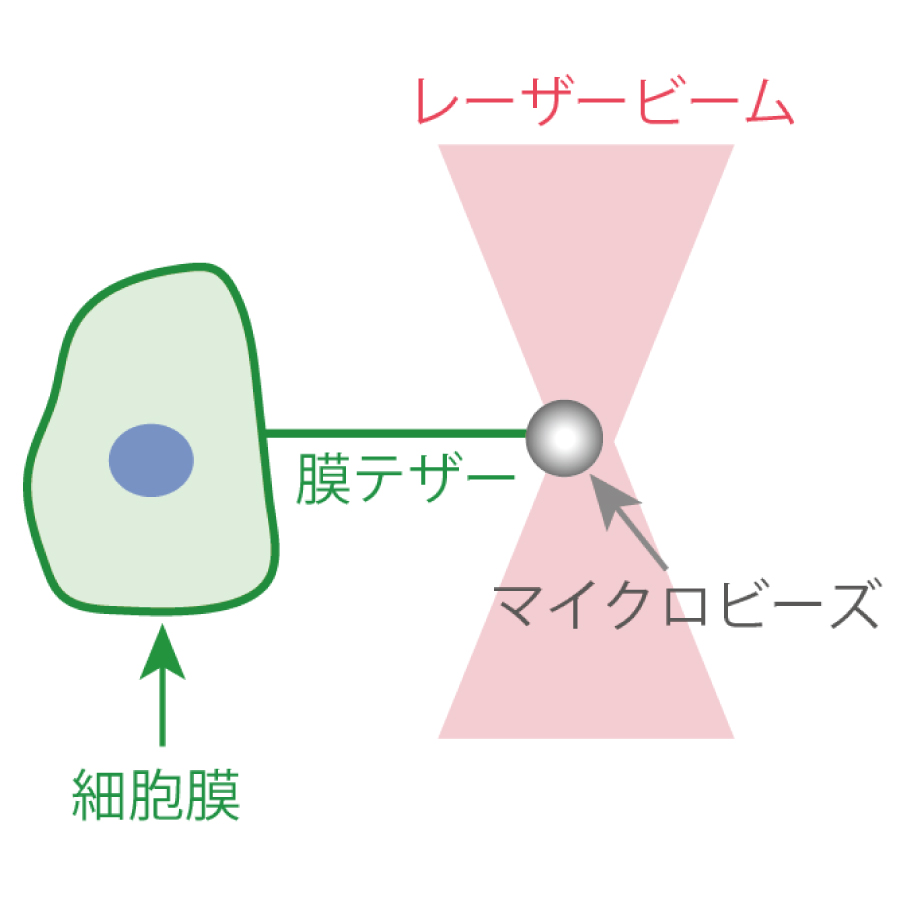
- 光ピンセット※
- 光ピンセットはレーザ光の集光により、マイクロビーズを捕捉し動かすことができる技術です。この捕捉したビーズを細胞膜に付着させて引っ張ることにより膜テザー(膜の紐状構造)が形成され、細胞膜の硬さを測定することができます。ミクロな「ばねばかり」のようなもので、光ピンセットの発明は2018年にノーベル物理学賞を受賞しました。
謝辞
本研究は、日本医療開発機構(AMED)革新的先端研究開発支援事業(AMED-PRIME)「癌細胞の浸潤・転移を司る細胞膜の張力を介したシグナル伝達機構の解明」(研究開発代表者:辻田和也)ならびに日本学術振興会科研費(新学術領域研究、基盤研究、萌芽研究、若手研究)の支援を受けて行われました。
論文情報
- タイトル
- “Homeostatic membrane tension constrains cancer cell dissemination by counteracting BAR protein assembly”
- Doi
- 10.1038/s41467-021-26156-4
- 著者
- Kazuya Tsujita1,2,3, Reiko Satow4, Shinobu Asada4, Yoshikazu Nakamura4,5, Luis Arnes6, Keisuke Sako7, Yasuyuki Fujita8, Kiyoko Fukami4, and Toshiki Itoh1,2
1. Biosignal Research Center, Kobe University, Kobe, Hyogo, 657-8501, Japan.
2. Department of Biochemistry and Molecular Biology, Kobe University Graduate School of Medicine, Kobe, Hyogo 650-0017, Japan.
3. AMED-PRIME, Japan Agency for Medical Research and Development, Tokyo 100-0004, Japan.
4. Laboratory of Genome and Biosignals, Tokyo University of Pharmacy and Life Sciences, Hachioji, Tokyo 192-0392, Japan.
5. Department of Applied Biological Science, Faculty of Science and Technology, Tokyo University of Science, Noda, Chiba, 278-8510, Japan.
6. The Novo Nordisk Foundation Center for Stem Cell Biology (DanStem), Biotech Research & Innovation Centre, University of Copenhagen, Copenhagen, Denmark
7. National Cerebral and Cardiovascular Center Research Institute, Osaka 565-8565, Japan
8. Division of Molecular Oncology, Graduate School of Medicine, Kyoto University, Kyoto 606-8501, Japan. - 掲載誌
- Nature Communications
関連リンク
本件に関するお問い合わせ
- 東京薬科大学 総務部 広報課
-
- 042-676-6711(8:45~17:00 月~金、祝日は除く)
- お問い合わせフォーム








