ニュース&トピックス 鎌状赤血球症の新しい治療薬候補を開発~ヒストンメチル化酵素G9aの新しい阻害剤RK-701~|プレスリリース
- 生命科学部
- 分子生命科学科
- 研究活動
2023.01.13
プレスリリース
東京薬科大学生命科学部の伊藤昭博教授(理化学研究所(理研)環境資源科学研究センターケミカルゲノミクス研究グループ客員主管研究員、科技ハブ産連本部創薬・医療技術基盤プログラムプロジェクトリーダー)、理研環境資源科学研究センターケミカルゲノミクス研究グループの吉田稔グループディレクター、東京薬科大学生命科学部の高瀬翔平特別研究員(PD)、微生物化学研究会微生物化学研究所の川田学部長らの共同研究グループは、ハイスループットスクリーニング[1]から得られたヒット化合物を基に合成した1,000種類以上の誘導体の構造活性相関[2]研究により、ヒストンメチル化[3]酵素G9aに対する新しい阻害剤「RK-701」の開発に成功し、RK-701によって発現するBGLT3長鎖ノンコーディングRNA[4](BGLT3 lncRNA)が鎌状赤血球症[5]患者の胎児型ヘモグロビン(HbF)[6]の誘導に普遍的な役割を持つことを発見しました。
本研究成果は、鎌状赤血球症の新しい治療薬の開発に貢献すると期待できます。
今回、共同研究グループは、特異的かつ低毒性で強力な新しいG9a阻害剤RK-701を開発しました。遺伝性疾患である鎌状赤血球症の治療戦略として、胎児期に存在し、出生後失われるHbFを再誘導させるという考え方が提唱されています。RK-701は、既存の鎌状赤血球症治療薬であるヒドロキシウレアよりも高効率にHbFの発現を誘導しました。さらに、BGLT3 lncRNAがRK-701だけでなく、ヒドキシウレアを含む他の誘導剤によるHbFの再活性化に重要な役割を果たすことを突き止めました。
本研究は、オンライン科学雑誌『Nature Communications』(1月12日付:日本時間1月12日)に掲載されます。
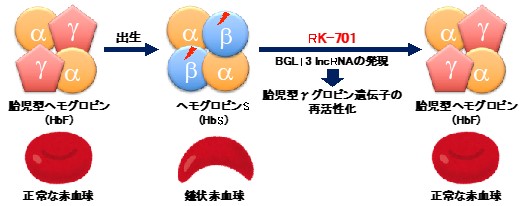
G9a阻害剤RK-701による鎌状赤血球症治療戦略
-
-
背景
ヘモグロビンは血液中で酸素を運搬する「運送屋」として機能する、αグロビン鎖[7]2分子と非αグロビン鎖[7]2分子から構成される4量体タンパク質です。ヒトでは出生後に、非αグロビン鎖としてγグロビン鎖を持つ「胎児型ヘモグロビン(HbF、α2γ2)」から、βグロビン鎖を持つ「成人型ヘモグロビン(HbA、α2β2)」への切り替え(グロビンスイッチング)が起こります。
鎌状赤血球症は、βグロビン遺伝子(HBB)の点変異[8]によりHbAが異常なヘモグロビンS(HbS)に変化することで発症し、溶血性貧血や血管閉塞性クリーゼを主症状とする遺伝性疾患です。赤血球の形が鎌状になることから、この疾患名が付けられました。
鎌状赤血球症の治療戦略として、出生後に発現が抑制されるHbFを再誘導するという方法が提唱されています。実際、HbF誘導活性を示すヒドロキシウレアが鎌状赤血球症治療薬として臨床の場で使用されていますが、DNAの合成を阻害するため安全性と有効性に問題があります。全世界で毎年約30万人の新生児が鎌状赤血球症を発症し、非常に多くの患者が存在することから、より強力で安全なHbF誘導薬の開発が強く求められています。
そのような背景の下、ヒストンメチル化酵素G9aの阻害剤UNC0638がHbF誘導活性を持つことが報告され、鎌状赤血球症の治療標的としてG9aが有望であることが分かりました注1)。G9aは、ヒストンH3の9番目のリジン残基のジメチル化(H3K9me2)を触媒する酵素です。しかし、UNC0638を含めた既存のG9a阻害剤は毒性が強く、治療薬として使用することはできません。また、G9aによる胎児型γグロビン遺伝子の発現抑制のメカニズムはよく分かっていませんでした。
-
-
-
研究手法と成果
- 共同研究グループは、まず約14万の化合物からG9a阻害活性を持つ化合物の探索を目的としたハイスループットスクリーニングを行いました。得られたヒット化合物とG9aの複合体の構造情報を基に化合物の最適化を行い、G9a阻害活性がヒット化合物よりも約200倍も高い「RK-701」の開発に成功しました(図1)。
RK-701は、関連するG9a以外のメチル基転移酵素に対して1,000倍以上の選択性を持ち、既存のG9a阻害剤と比較して著しく毒性が低く、薬物動態も良好でした。そこで、ヒト赤血球細胞に投与したところ、RK-701は胎児型γグロビンの発現を誘導し、既存の鎌状赤血球症治療薬ヒドロキシウレアよりも低濃度で優れた薬効を発揮することが分かりました。また、マウスにRK-701を投与すると、ヒトの胎児型γグロビンに相当する胚型εyグロビンの発現が誘導され、RK-701は動物モデルでも有効であることが分かりました。
- 共同研究グループは、まず約14万の化合物からG9a阻害活性を持つ化合物の探索を目的としたハイスループットスクリーニングを行いました。得られたヒット化合物とG9aの複合体の構造情報を基に化合物の最適化を行い、G9a阻害活性がヒット化合物よりも約200倍も高い「RK-701」の開発に成功しました(図1)。
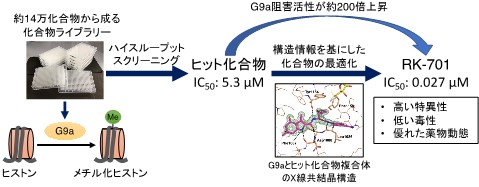 図1 G9a阻害剤RK-701の開発
図1 G9a阻害剤RK-701の開発約14万化合物からG9aのヒストンメチル化酵素活性を阻害する化合物を探索。得られたヒット化合物とG9aの複合体のX線共結晶構造を基に化合物の最適化を行い、G9a阻害活性がヒット化合物より約200倍上昇したRK-701の創製に成功した。
次に、RK-701を用いて、G9aによる胎児型γグロビン遺伝子の発現抑制機構を調べました。RK-701により発現が増加する遺伝子を網羅的に調べたところ、数ある胎児型γグロビン発現制御因子の中で、BGLT3遺伝子の発現だけが非常に増加していることが分かりました。BGLT3は、胎児型γグロビン発現誘導活性を持つ長鎖ノンコーディングRNA(IncRNA)です。細胞内のBGLT3(BGLT3 lncRNA)の発現を低下させると、RK-701による胎児型γグロビンの発現誘導がほぼ完全に抑制されました(図2右上)。これらの結果から、G9aによる胎児型γグロビン遺伝子の発現抑制にBGLT3が重要な役割を果たしていることが分かりました(図2)。
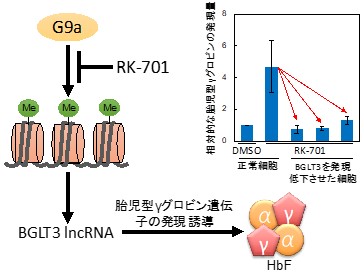 図2 BGLT3 IncRNA依存的なRK-701によるHbF誘導
図2 BGLT3 IncRNA依存的なRK-701によるHbF誘導ヒト赤芽球細胞株HUDEP-2細胞において、溶媒として用いたDMSO処理と比較して、RK-701処理により胎児型γグロビンの発現が増加した。RNA干渉法によりBGLT3(BGLT3 lncRNA)の発現を低下させると、このRK-701による胎児型γグロビンの発現増加はほぼ完全に抑制された(右上のグラフ)。G9aによる胎児型γグロビン遺伝子の発現抑制に、BGLT3が重要な役割を果たしている。
さらに、G9aによるBGLT3発現抑制機構を調べました。BCL11AとZBTB7Aは、胎児型γグロビン遺伝子の主要な転写抑制因子[9]として働くことが知られています。これらの転写抑制因子を欠損させると、(1)BGLT3の発現が高まりRK-701によるBGLT3の発現増加が見られなくなること、(2)BGLT3遺伝子座のH3K9me2レベルが低下することから、これらの転写抑制因子とG9aは協調してBGLT3の発現を抑制しているらしいことが分かりました。さらに(3)二つの転写抑制因子はG9aと相互作用してG9aをBGLT3遺伝子座付近に動員することによりH3K9me2の上昇を誘導し、BGLT3の発現を抑制することが示唆されました。
一方、G9aによるBGLT3遺伝子座付近のH3K9me2の増加は、H3K9me2結合タンパク質であるCHD4を介してBGLT3遺伝子座付近へのBCL11AおよびZBTB7Aの動員を増加させました。以上の結果から、これらの転写抑制因子がG9aをBGLT3遺伝子座付近へ誘導して近傍のH3K9me2を増加させ、それがCHD4を介してBGLT3遺伝子座付近に転写抑制因子を動員させH3K9me2がさらに増加するというH3K9me2が増幅される仕組みがBGLT3の発現抑制、ひいては胎児型γグロビン遺伝子の発現抑制の分子基盤であることが示されました(図3)。-
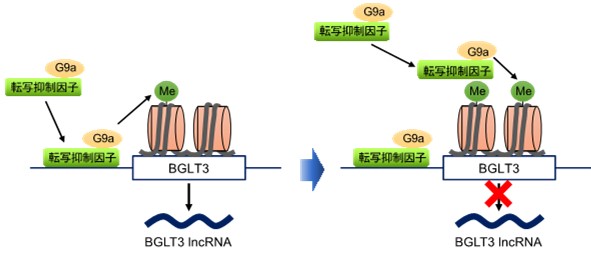 図3 G9aによるBGLT3(BGLT3 lncRNA)発現抑制機構
図3 G9aによるBGLT3(BGLT3 lncRNA)発現抑制機構BCL11AとZBTB7Aという2種類の転写抑制因子がBGLT3遺伝子近傍に結合すると、それらが相互作用するG9aをBGLT3遺伝子近傍に呼び寄せる。すると、G9aによりBGLT3遺伝子座のヒストンH3がメチル化される(左)。メチル化されたヒストンH3は、転写抑制因子複合体に含まれるCHD4と相互作用することで、さらに転写抑制因子をヒストン領域に動員し、その結果G9aによるヒストンH3メチル化が増大する(右)。こうしてBGLT3遺伝子座は次々とメチル化が拡大され、その遺伝子発現が抑制されると考えられる。
既存薬であるヒドロキシウレアに加えて、DNAメチル化酵素[10]の阻害剤やヒストン脱アセチル化酵素[11]の阻害剤も、胎児型γグロビンの発現を増加させることが知られています。胎児型γグロビン発現誘導におけるBGLT3 lncRNAの重要性は、RK-701によるものだけにとどまりませんでした。つまり、ヒドロキシウレアを含めたこれらの阻害剤もBGLT3の発現を増加させること、BGLT3の発現を低下させると胎児型γグロビンの発現増加が抑制されることを明らかにしました。胎児期に発現するγグロビン遺伝子は、霊長類の中でもヒトを含む真猿類[12]に存在していますが、より原始的な原猿類[13]には存在しません。同様に、BGLT3遺伝子も真猿類に存在しますが、原猿類には存在しないことから、胎児型γグロビン遺伝子とBGLT3遺伝子は協調的に進化してきた可能性があります。以上の結果から、BGLT3は高等動物が進化上獲得したHbFの普遍的な活性化因子であると考えられます。
-
-
今後の期待
- 本研究では、新しい化学構造を持ち、特異的かつ強力なG9a阻害剤RK-701の開発に成功しました。RK-701は、UNC0638などの一般的なG9a阻害剤よりも毒性が著しく低く、既存の治療薬であるヒドロキシウレアよりも優れた安全性と有効性を示したことから、鎌状赤血球症治療薬として大いに期待できます。
- また、本研究により、BGLT3 lncRNAが胎児型γグロビン遺伝子発現の普遍的な活性化因子であることが明らかになりました。RK-701だけでなく、安全にBGLT3 IncRNAの発現を高める方法を見いだすことができれば、鎌状赤血球症の新たな治療薬の開発につながると期待できます。
- 本研究成果は、国際連合が2016年に定めた17項目の「持続可能な開発目標(SDGs)[14]」のうち、「3.すべての人に健康と福祉を」に貢献するものです。
論文情報
- タイトル
- A specific G9a inhibitor unveils BGLT3 lncRNA as a universal mediator of chemically induced fetal globin gene expression
- 著者氏名
- Shohei Takase, Takashi Hiroyama, Fumiyuki Shirai, Yuki Maemoto, Akiko Nakata, Mayumi Arata, Seiji Matsuoka, Takeshi Sonoda, Hideaki Niwa, Shin Sato, Takashi Umehara, Mikako Shirouzu, Yosuke Nishigaya, Tatsunobu Sumiya, Noriaki Hashimoto, Ryosuke Namie, Masaya Usui, Tomokazu Ohishi, Shun-ichi Ohba, Manabu Kawada, Yoshihiro Hayashi, Hironori Harada, Tokio Yamaguchi, Yoichi Shinkai, Yukio Nakamura, Minoru Yoshida, Akihiro Ito
- 雑誌
- Nature Communications
- 論文情報
-
- DOI: 10.1038/s41467-022-35404-0
-
-
-
鎌状赤血球症の新しい治療薬候補を開発~ヒストンメチル化酵素G9aの新しい阻害剤RK-701~|プレスリリース
※[1]~[14]の用語解説については、上記PDFをご覧ください。
-
-
-
-
関連リンク
-
-
-
-
-
取材に関するお問い合わせ先
- 東京薬科大学 総務部 広報課
-
- 042-676-6711(8:45~17:00 月~金、祝日は除く)
- お問い合わせフォーム
研究に関するお問い合わせ先
- 東京薬科大学 生命科学部 細胞情報科学研究室 教授 伊藤 昭博









