ニュース&トピックス 染色体レベルでのヒト iPS 細胞のエンジニアリングに成功 ~遺伝子細胞治療、疾病モデル細胞の作製、創薬研究等への応用へ期待~|プレスリリース
- 生命科学部
- 応用生命科学科
- SDGs
- 研究活動
2021.01.18

プレスリリース
染色体レベルでのヒト iPS 細胞のエンジニアリングに成功~遺伝子細胞治療、疾病モデル細胞の作製、創薬研究等への応用へ期待~
ヒト人工多能性幹細胞(以下、ヒト iPS 細胞)に、外来遺伝子を発現させるためのベクターの開発は、産業・医療への応用面において重要な役割を果たしてきました。しかし、品質が確認されたヒト iPS 細胞に、直接的に染色体を導入する技術とその応用については未だ開発途上です。 このたび、鳥取大学医学部 生命科学科 細胞ゲノム機能学分野の香月 康宏准教授らの研究グループ※が、ヒト iPS 細胞への、染色体レベルでの遺伝子群を導入することに成功し、その応用として3つの有効例を示すことに成功しました。これにより、これまでになかった遺伝子細胞治療、疾病モデル細胞の作製、創薬研究等への応用が期待されます。
-
※東京薬科大学、京都大学、キリンホールディングスの研究者を含む研究グループ。本学より生命科学部 生物工学研究室 冨塚一磨教授、宇野愛海助教が参画。
- 独自に開発してきた麻疹ウイルスエンベロープタンパク質を用いた微小核細胞融合法をヒトiPS 細胞に適応することで各種染色体ベクターのヒト iPS 細胞への導入に成功しました。
- ジストロフィン遺伝子全長 2.4Mb を搭載した HAC ベクターを筋ジストロフィー患者由来 iPS 細胞に導入し、遺伝子修復を行いました。
- 改変 HAC ベクターを T 細胞由来ヒト iPS 細胞に導入後、改変 HAC ベクター上に目的遺伝子を搭載するシステムを確立し、T 細胞系譜に分化誘導後も目的遺伝子が安定的に発現できることを実証しました。
- ヒト 21 番染色体を正常ヒト iPS 細胞に導入することで、人工的にダウン症候群モデル iPS 細胞を作成しました。
概要
鳥取大学医学部生命科学科/染色体工学研究センター 香月康宏准教授、東京薬科大学冨塚一磨教授/宇野愛海助教、京都大学 iPS 細胞研究所 金子新教授、キリンホールディングスは鳥取大学発の独自の染色体導入技術をヒト iPS 細胞に適応し、染色体レベルで巨大な遺伝子群を安全にヒト iPS 細胞に導入することでヒト iPS 細胞の染色体レベルでのエンジニアリングに成功しました。本研究成果は「Molecular Therapy-Nucleic Acids」2020 年 12 月19 日(オンライン版)に掲載されました。本研究成果はヒト iPS 細胞の染色体レベルでの効率的なエンジニアリングに繋がるとともに遺伝子・細胞治療、疾患モデル細胞の作製、創薬研究などへの応用が期待されます。
背景
ヒト人工多能性幹細胞(ヒト iPS 細胞)に外来遺伝子を発現させるためのベクターの開発は産業や医療への応用面において重要な役割を果たしてきました。従来のトランストランスジェニック技術では導入できる遺伝子サイズに制限があり、導入された遺伝子は宿主の染色体に組み込まれることから、安全性・遺伝子発現制御に課題がありました。これらを解決できる一つの方法は自立複製・分配が可能なヒト人工染色体(HAC)、あるいはヒト染色体をベクターとして利用して遺伝子(群)を導入することです。一方、従来のポリエチレングリコール(PEG)法を用いた染色体導入法(PEG-MMCT: PEG による微小核細胞融合法)ではヒト iPS 細胞への染色体ベクターの導入は困難であり、これまではヒト繊維芽細胞に HAC ベクターを導入後にヒト iPS 細胞を誘導してきました(図1上図)。この方法だと、ヒト iPS 細胞の品質を制御することが難しく、遺伝子・細胞治療研究や創薬研究を効率的に行うことが困難でした。品質が確認されたヒト iPS 細胞に直接的に染色体を導入する技術開発とその応用についての研究が求められてきました。
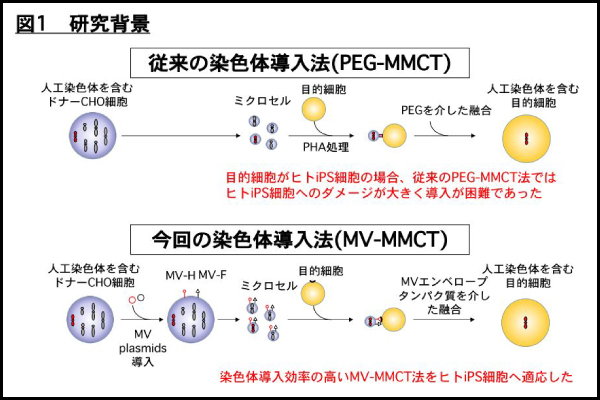 図1 研究背景
図1 研究背景
研究成果
上記課題を解決するために、我々は独自に開発してきた麻疹ウイルスエンベロープタンパク質を用いた染色体導入法(MV-MMCT: MV による微小核細胞融合法)をヒト iPS 細胞に適応しました(図 1 下図)。本研究では以下の図 2 に示す3つの応用例を示すことで染色体レベルで遺伝子群を導入することの有用性を示すことに成功しました(図 2)。具体的には、1)ジストロフィン遺伝子全長 2.4Mb を搭載した HAC ベクター(DYS-HAC と呼ぶ)を筋ジストロフィー患者由来 iPS 細胞に導入し、遺伝子修復を行いました。2)改変 HAC ベクターを T 細胞由来ヒト iPS 細胞に導入後、改変 HAC ベクター上に目的遺伝子を搭載する系を確立し、T 細胞系譜に分化誘導後も目的遺伝子が安定的に発現できることを実証しました。3)ヒト 21 番染色体を正常ヒト iPS 細胞に導入することで、ダウン症候群モデル iPS 細胞を作成しました。
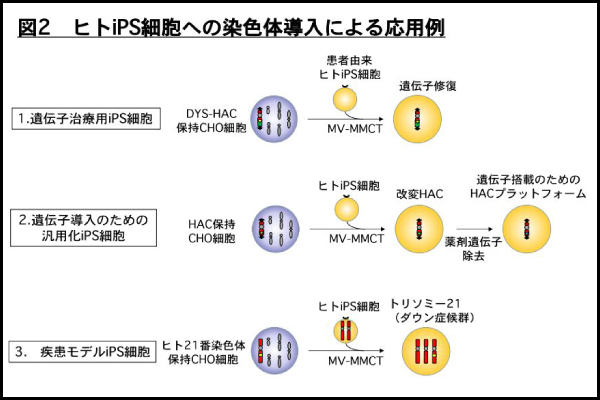 図2 ヒトiPS細胞への染色体導入による応用例
図2 ヒトiPS細胞への染色体導入による応用例
まずはじめに、デュシェンヌ型筋ジストロフィー(DMD)の安全な遺伝子・細胞治療を目指して、MV-MMCT 法を用いて、ジストロフィン遺伝子全長 2.4Mb を搭載した HAC ベクター(DYS-HAC と呼ぶ)を DMD 患者由来 iPS 細胞に導入しました。この DMD 患者さん由来の細胞ではジストロフィン遺伝子のエクソン 4〜43 が欠損していることが分かっています。あらかじめ、染色体への非挿入型の RNA 型ウイルスである Sendai-virus(Sev)を用いて初期化因子(山中因子)を DMD 患者由来繊維芽細胞に導入することで DMD-iPS 細胞を誘導しました。次に DYS-HAC を MV-MMCT 法を用いて上記 Sev 誘導型 DMD-iPS 細胞に導入しました。その結果、患者さん由来細胞で欠損しているエクソン 4〜43 が DYS-HAC の導入により、修復されていることがマルチプレックス PCR解析により確認されました(図 3 左)。次に、DYS-HAC 導入 DMD-iPS 細胞を FISH 解析により、染色体を解析したところ、DYS-HAC ベクターは宿主の染色体に挿入されず独立に 1 本維持されていることが確認できました。以上のことから、iPS 誘導と遺伝子修復の両方の面から、染色体非挿入型のベクター系(Sev および HAC)で実証することができたことから、がん化のリスクが少ない安全な遺伝子修復済みの DMD-iPS 細胞の樹立に成功したと言えます。
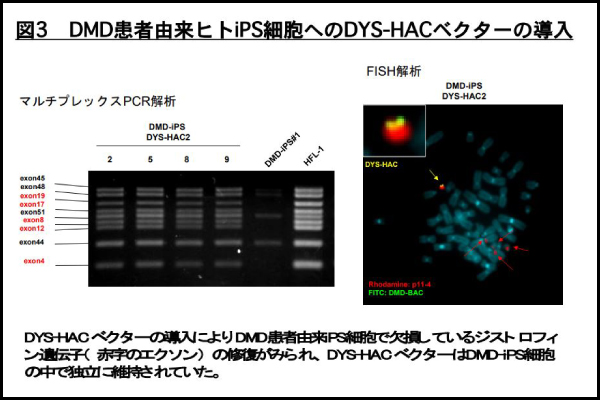 図3 DMD患者由来ヒトiPS細胞へのDYS-HACベクターの導入
図3 DMD患者由来ヒトiPS細胞へのDYS-HACベクターの導入
次にヒト iPS 細胞に効率的に目的遺伝子を搭載することを目指して、HAC ベクターを一部改良し、その改変 HAC を MV-MMCT 法を用いて、T 細胞由来ヒト iPS 細胞に導入しました。さらに、T-iPS細胞の中で HAC 上に目的遺伝子を効率的に挿入するために薬剤耐性遺伝子を除去しました(図 2 中段図)。次に目的遺伝子として、クサビラオレンジ(KO1)という蛍光遺伝子(plasmid)を TiPS 細胞中の HAC 上へ部位特異的イングレースを発現させることで搭載しました。FISH 解析により、HAC は宿主の染色体に挿入されず、独立に維持されており、また、KO1 遺伝子も宿主染色体に挿入されず、目的どうりに HAC 上に特異的に搭載されていることが確認されました(KO1-HAC とよぶ)(図4左列)。T 細胞由来ヒト iPS(T-iPS)細胞は T 細胞系譜に分化しやすい性質を持っています。そこで、KO1-HAC 導入ヒト T-iPS 細胞を T 細胞系譜に分化誘導をしました。HAC 上には元々GFP という緑色の蛍光遺伝子が搭載されています。未分化状態、Sac という少し分化させた状態で HAC 上の GFP 遺伝子の緑色蛍光と KO1 遺伝子の赤色蛍光が同時に観察されました(図4中列)。さらに T 細胞系譜に分化させた状態において(CD3 という表面マーカーが陽性)、KO1 遺伝子が 95.7%陽性であることが分かりました(図4右列)。以上のことから、ヒト iPS 細胞において簡便なplasmid導入法により、HAC上に効率良く目的遺伝子を搭載することが可能となり、未分化、T 細胞分化後においても目的遺伝子の発現が安定に維持されることが明かとなりました。これまで、染色体導入法(MMCT 法)は技術的困難性が高く、通常の研究室では実施することが困難でしたが、HAC が導入されたヒト iPS 細胞が樹立されたことで、誰でも簡便に目的遺伝子を安定にヒト iPS 細胞中で発現させることが可能となりました。
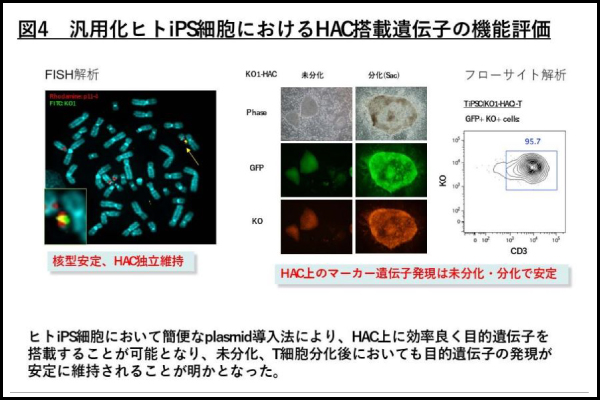 図4 汎用化ヒトiPS細胞におけるHAC搭載遺伝子の機能評価
図4 汎用化ヒトiPS細胞におけるHAC搭載遺伝子の機能評価
最後にヒト 21 番染色体を MV-MMCT 法で正常ヒト iPS 細胞に導入することで、ダウン症候群モデル iPS 細胞を作成しました。ダウン症候群(通称:ダウン症)はヒト 21 番染色体のトリソミー(正常はヒト 21 番が 2 本だが 3 本になること)によって引き起こされる先天性疾患です。マルチカラーFISH 解析の結果、正常のヒト iPS 細胞(親株)はヒト 21 番を含む常染色体が1 対(2 本)ずつ存在するのに対して(図 5 上段左)、ヒト 21 番染色体を導入したトリソミー21-iPS 細胞ではヒト 21 番染色体のみが 3 本存在することが確認されました(図 5 上段右)。次に、正常 iPS 細胞とトリソミー21iPS 細胞を神経系譜に分化誘導したところ、神経分化マーカーの発現が検出されました(図 5 下段)。これまでにもダウン症由来 iPS 細胞が作製されてきましたが、その多くの例において、比較対象となる正常ヒト iPS 細胞は他人由来(ダウン症患者由来ではない)であったことから、様々な比較試験において、ダウン症特有の現象であるかを見分けることが困難な場合がありました。今回の実験では比較対象となる正常ヒト iPS 細胞にヒト 21 番染色体のみを導入していることから、同一遺伝的背景で 2 つの細胞を比較することが可能です。このようなトリソミー21-iPS 細胞(ダウン症モデル iPS 細胞)はダウン症候群の様々な症状に対応する原因遺伝子の解明や種々の症状改善のための治療法、治療薬開発にとって極めて有用な研究資材となることが期待されます。
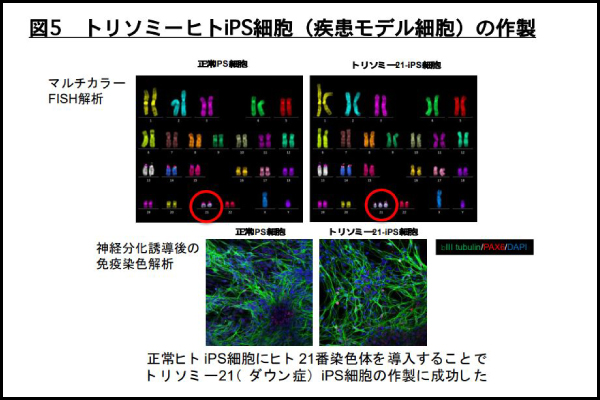 図5 トリソミーヒトiPS細胞(疾患モデル細胞)の作製
図5 トリソミーヒトiPS細胞(疾患モデル細胞)の作製
将来の展望
HAC ベクターの利点は以下の3つの特徴があります。 1)宿主染色体に挿入されず独立して維持されることから、宿主遺伝子を破壊しない。 2)一定のコピー数で安定に保持され,プロモーターを含む大きな遺伝子領域を導入することにより宿主細胞の生理的発現制御を受けることから、過剰発現や発現消失が起きない。3)導入可能な DNA サイズに制約がないことから、発現調節領域を含む遺伝子や複数遺伝子/アイソフォームの導入が可能となる。このように従来のベクター系(ウイルス、YAC, BAC, PAC, plasmid など)にはない利点を有していることから新たな機能解析のためのベクター系として、さらに遺伝子・細胞治療用のベクターとしても有用であると期待されています。従って、本研究で開発したヒト iPS 細胞への染色体導入法はヒト iPS 細胞の染色体レベルでの効率的なエンジニアリングに繋がるとともに遺伝子・細胞治療、創薬研究などへの応用が期待されます。
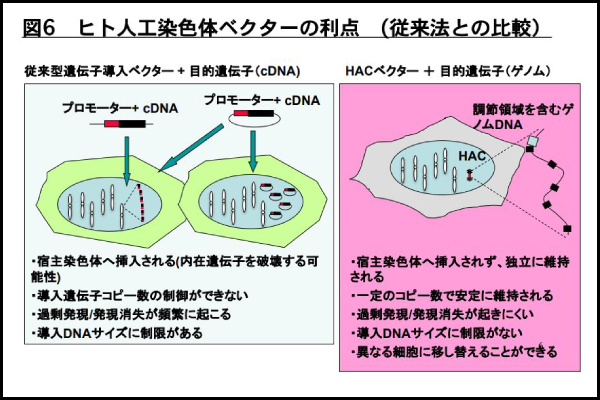 図6 ヒト人工染色体ベクターの利点(従来法との比較)
図6 ヒト人工染色体ベクターの利点(従来法との比較)
掲載論文情報
- 題 名
- Engineering of human induced pluripotent stem cells via human artificial chromosome
vectors for cell therapy and disease modeling(ヒト人工染色体ベクターによる細胞治療および疾患
モデリングのためのヒト人工多能性幹細胞のエンジニアリング) - 掲載誌
- Molecular Therapy-Nucleic Acids(https://doi.org/10.1016/j.omtn.2020.12.012
)
- 掲載日
- 2020 年 12 月 19 日
- 著 者
- Yasuhiro Kazuki, Narumi Uno, Satoshi Abe, Naoyo Kajitani, Kanako Kazuki, Yuwna Yakura, Chiaki Sawada, Shuta Takata, Masaki Sugawara, Yuichi Nagashima, Akane Okada, Masaharu Hiratsuka, Mitsuhiko Osaki, Giulia Ferrari, Francesco Saverio Tedesco, Satoshi Nishikawa, Ken Fukumoto, Shin-ichiro Takayanagi, Atsushi Kunisato, Shin Kaneko, Mitsuo Oshimura and Kazuma Tomizuka
研究支援
本研究は科学技術新興機構(JST)戦略的創造研究推進事業(CREST)、日本医療研究開発機構(AMED)などの支援を受けて行われました。
関連リンク
【取材に関するお問い合わせ先】
- 東京薬科大学 総務部 広報課
-
- 042-676-6711(8:45~17:00 月~金、祝日は除く)
- お問い合わせフォーム
【研究に関するお問い合わせ先】
- 東京薬科大学 生命科学部 生物工学研究室 教授 冨塚一磨
-
- 042-676-7139(8:45~17:00 月~金、祝日は除く)
- tomizuka@toyaku.ac.jp








