ニュース&トピックス 稀少疾患である大脳白質形成不全症のメカニズムの解明 -- 新規の創薬標的候補分子としてのキャスパーゼ-2|プレスリリース
- 生命科学部
- 分子生命科学科
- SDGs
- 研究活動
2022.02.25
プレスリリース
稀少疾患である大脳白質形成不全症のメカニズムの解明 -- 新規の創薬標的候補分子としてのキャスパーゼ-2
ポイント
- 研究の背景
- 中枢神経系の真ん中にあり、ヒトでは膨大な体積を有する大脳はきわめて複層的な階層からできており、それぞれの階層が多種類のニューロン(神経細胞)およびグリア細胞、その他の細胞群から構成される。神経細胞は神経信号の伝達機能を担い、グリア細胞は神経細胞を保護する役割をもつとされている。しかし最近の研究からグリア細胞はこのような神経細胞への補佐的な役割ばかりではなく、主体的に神経信号の伝達機能を担うことが明らかになった。そのためグリア細胞に異常がおきると神経細胞にも重篤な障害がおきるのである。そのなかに、遺伝的要因で発症するペリチェウス・メルツバッヘル病(Pelizaeus-Merzbacher disease)がある。この病気は先天性大脳白質形成不全症とよばれる一群の治療困難な病気(難病)のひとつとして位置付けられている。先天性大脳白質形成不全症は希少疾患でもあり20万人から50万人にひとりにおこる。これは国内外で同じ頻度である。
- 成果について
- AIMP2の変異が原因でおこる先天性大脳白質形成不全症の細胞モデルを先駆けて作成し、その細胞病態の原因が稀におこるゴルジ体ストレスであることを突きとめた。AIMP2とよばれるタンパク質に異常が生じると、それがゴルジ体に蓄積してグリア細胞の分化や発生に異常をもたらすと考えられた。一方、これらの異常はキャスパーゼ-2というタンパク質分解酵素を阻害することで改善できることを明らかにした。
- 今後の展望
- 研究成果が細胞モデルの結果を中心としているため、これらが当研究室で独自に開発した共培養システムによる人工組織でも本病態を再現できるか検討し、マウスモデルにおいても再現できるか明らかにしなければならない。その過程において前臨床試験を行い、キャスパーゼ-2の阻害剤やRNA薬を用いて治療効果が期待できるか検討したい。
概要
AIMP2とよばれるタンパク質はタンパク質翻訳システムの中核をなす分子である。先行研究においては、疾患で、このタンパク質が未成熟の状態でできあがるため、タンパク質翻訳システムが機能異常に陥り、脳の異常につながると考えられていた。しかし今回、この未成熟なAIMP2がゴルジ体に蓄積し、ストレス応答を誘導することで、先天性大脳白質形成不全症の細胞病態(分化阻害など)がおこることが判明した。また重要なことにキャスパーゼ-2を阻害することで、細胞病態の多くの異常が改善できることも明らかにした。
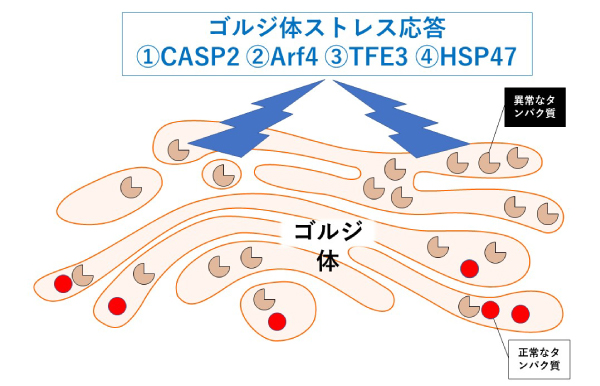 図1 通常は細胞質に存在するAIMP2は疾患変異によりゴルジ体に蓄積し細胞に異常をもたらす。そのストレスとして4種類のメカニズムが知られているが、この細胞病態では①のキャスパーゼ-2(CASP2)が異常に活性化されることを明らかにした。
図1 通常は細胞質に存在するAIMP2は疾患変異によりゴルジ体に蓄積し細胞に異常をもたらす。そのストレスとして4種類のメカニズムが知られているが、この細胞病態では①のキャスパーゼ-2(CASP2)が異常に活性化されることを明らかにした。
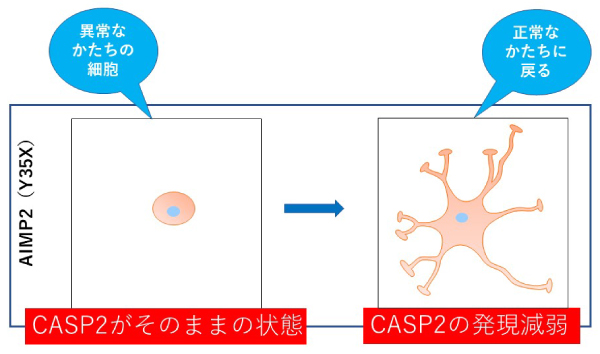 図2 キャスパーゼ-2(CASP2)の発現減弱(抑制)により細胞分化の阻害などの細胞病態が改善することを見いだした。つまりキャスパーゼ-2は本疾患の創薬標的候補分子である。
図2 キャスパーゼ-2(CASP2)の発現減弱(抑制)により細胞分化の阻害などの細胞病態が改善することを見いだした。つまりキャスパーゼ-2は本疾患の創薬標的候補分子である。
これらの研究は東京薬科大学生命科学部分子神経科学研究室の博士前期課程(修士課程)2年の落合愛理沙らを中心にして行われた研究成果です。
原著論文
国際神経化学誌(Neurochemical Research)に掲載される (The ISN-APSN meeting (Kyoto) special issue [国際学会特集号])
- 雑誌名
- Neurochemical Research
- 論文名
- Knockdown of Golgi stress-responsive caspase-2 ameliorates HLD17-associated AIMP2 mutant-mediated inhibition of oligodendroglial cell morphological differentiation
- 著者
- Arisa Ochiai(落合愛理沙、筆頭著者), Sui Sawaguchi, Shiori Memezawa, Yoichi Seki, Takako Morimoto, Hiroaki Oizumi, Katsuya Ohbuchi, Masahiro Yamamoto, Kazushige Mizoguchi, Yuki Miyamoto, and Junji Yamauchi(山内淳司、責任著者)
- リンク
- Doi
- 10.1007/s11064-021-03451-6
関連リンク
取材に関するお問い合わせ先
- 東京薬科大学 総務部 広報課
-
- 042-676-6711(8:45~17:00 月~金、祝日は除く)
- お問い合わせフォーム
研究に関するお問い合わせ先
- 東京薬科大学 生命科学部 分子神経科学研究室 教授 山内淳司
-
- 042-676-7164
- yamauchi@toyaku.ac.jp









