ニュース&トピックス 尿酸値と神経変性疾患発症リスクとの関連を明らかに〜ヒトの脳におけるプリンサルベージ経路の重要性の証明及びその増強による新たな進行防止戦略〜|プレスリリース
- 薬学部
- プレスリリース
- 研究活動
2024.07.09
ポイント
- 高尿酸血症や痛風患者は認知症の発症リスクが少ないことはよく知られています。
- 痛風治療薬であるキサンチン酸化還元酵素(XOR)阻害薬と神経変性疾患との関係については活性酸素説を含む諸説はあるものの実験的解明はされていませんでした。
- 本報告はヒト脳組織及びiPS細胞由来神経細胞を用いてXORの活性酸素説を排し、プリンサルベージ経路がde novo 経路に比べて効率よくATPを合成維持することを実験的に解明しました。
- XOR阻害薬とペントース及びプリン体の摂取がサルベージ活性を増強することも実験的に明らかにしました。
- プリンサルベージ経路を介してATPレベルを飽和まで維持することは神経変性疾患や、エネルギー枯渇や虚血を病態とする疾患に対する新たな治療戦略として期待されます。
概要
東京薬科大学薬学部 関根舞助教、市田公美名誉教授(前教授)は、東京大学大学院農学生命科学研究科 永田宏次教授、岡本研特任研究員、カリフォルニア大学 Russ Hille教授、日本医科大学 藤原めぐみ助教、西野武士名誉教授(研究主宰者)との共同研究を行い、ヒトの脳におけるプリンサルベージ経路の重要性を明らかにし、その活性を増強させる方法を見出しました。この成果は、日本時間2024年7月1日に米国生化学・分子生物学会の発行するJournal of Biological Chemistryのオンライン版で発表されました。
研究背景
ヒトにおけるプリン異化の最終産物である尿酸は、キサンチン酸化還元酵素(XOR)が触媒するヒポキサンチンからキサンチン、キサンチンから尿酸への2段階反応を経て生成されます。血中尿酸値は尿酸の産生と排泄のバランスによって維持されており、その変動は遺伝、食事、生活習慣など多くの因子の影響を受けています。高尿酸血症は痛風や腎臓病、心血管疾患の危険因子である一方、疫学的研究により、アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症などの神経変性疾患のリスクを低下させ、神経可塑性や認知機能に有益であることが示唆されていました。神経変性疾患の病態には酸化ストレスが関与しており、尿酸の強い抗酸化作用はこれら疾患のリスク低減のメカニズムとして考えられてきました。また、低尿酸血症と神経変性疾患リスク上昇との関連は、低い血中尿酸値による抗酸化能の低下によるものと考えられていました。しかし、現在までのところ、ヒトの脳中尿酸値と神経変性疾患との関連性についてのデータはありませんでした。また、XORの酸化型(XO)は活性酸素種(ROS)の主要な供給源であると考えられており、虚血再灌流障害などの機序に関与しているとされてきました。そのため、アロプリノールやフェブキソスタットなどのXOR阻害薬は活性酸素を除去することで組織保護作用を発揮すると提唱されてきましたが、尿酸生成も抑制するため、そのメカニズムは一貫しているとは言えません。
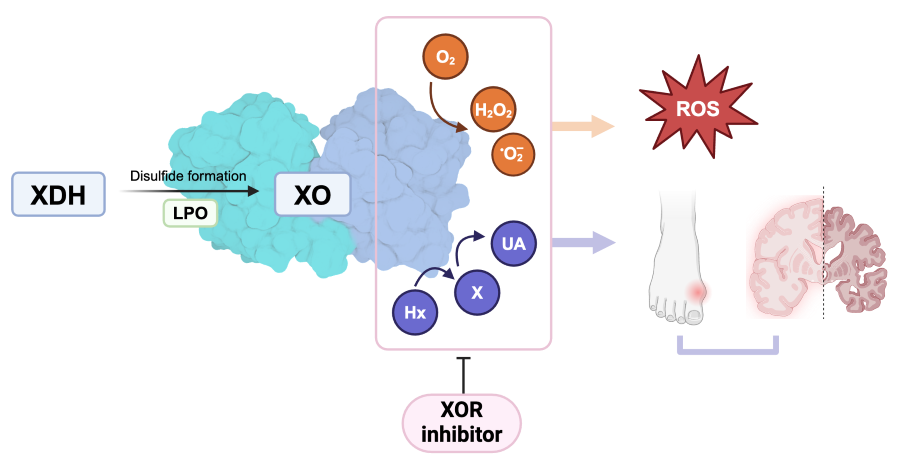 図1. XORの生成物と病態への関与
図1. XORの生成物と病態への関与
研究内容
本研究では、ヒト脳組織を用いてXORの発現、生成物及び活性を調べたところ、脳のさまざまな領域でXOR発現がなく、尿酸も総プリン体のうち約1%と少ないことが明らかになりました。また、生理的にはXORの脱水素酵素(XDH)からXOへの変換に必須とするラクトペルオキシダーゼ(LPO)の発現も認められませんでした。これらの結果は、尿酸が生物学的に必須な抗酸化物質であるという長年信じられてきた見解に疑問を投げかけるものです。その一方で、プリンサルベージ経路の中心的な酵素であるヒポキサンチンホスホリボシルトランスフェラーゼ(HPRT)の発現は脳で高く、ヒポキサンチンが顕著に蓄積していることを確認しました。脳細胞ではXORがなくHPRTが高いことはプリンサルベージ経路に利用できるヒポキサンチンを保つため、大量のエネルギーを必要とする脳において高い意義を持つと考えられます。Lesch-Nyhan症候群(HPRT欠損症)ではHPRTの活性低下が強い場合、幼少児から脳の強度萎縮がみられますが、弱い症例では脳萎縮とともにタウ蛋白質の蓄積が文献的に報告されています。本研究では脳におけるプリンサルベージ経路の重要性を明らかにするために、ヒトiPS細胞から分化誘導した神経細胞を導入しました。安定同位体分析の結果、プリンサルベージ経路はプリンde novo 経路よりもATP合成に有効であることが示されました。
ATPは細胞内プリン体の主体であり、過剰な運動、飲酒、ストレス、病的な状態などでは急速かつ大量に消費されます。持続的なストレスによりプリン体分解が継続すると、主にヒポキサンチンとして細胞外へ放出され、細胞内の総アデニル酸(ATP+ADP+AMP)は減少します。プリンde novo 経路は多量のATPを使用するため、エネルギー枯渇を速めます。失われた分が補充されなければ細胞損傷が起こり、極端な場合には細胞死に至る可能性があります。したがって、総アデニル酸レベルを維持するためには、早期のストレス緩和が必要です。
ストレス条件下において、XORの存在はヒポキサンチンのサルベージが起こる前にヒポキサンチンを再利用不能な尿酸として細胞外に放出させ、細胞内の総アデニル酸を減少させました。高尿酸血症・痛風治療薬であるXOR阻害薬は総アデニル酸のさらなる減少を防ぐことにより、細胞保護効果をもたらしました。またXOR阻害薬は、XORが存在する様々な臓器においてヒポキサンチンから尿酸までの反応の阻害により、細胞外ヒポキサンチンレベルの上昇に関連しています。ヒポキサンチンは血液脳関門を通過することができるので、神経細胞に取り込まれサルベージされると考えられます。
ヒトiPS細胞由来神経細胞のメタボローム解析の結果から、ヒポキサンチン添加によってサルベージが観察されましたが、PRPPの枯渇によりATP増強効果は限定的であることが示されました。そこでペントースリン酸経路の前駆体を添加したところ、ヒポキサンチンの取り込みが促進されることを確認し、PRPPの補充によるプリンサルベージの増強が示唆されました。また、細胞内の総アデニル酸レベルがほぼ飽和レベルまで上昇することが確認できました。
プリンサルベージ経路とde novo 経路のバランスの不均衡が認められる疾患(Lesch-Nyhan症候群、ダウン症など)では、アルツハイマー病に類似した病理所見が観察されます。総アデニル酸の減少は様々な生命活動に影響を与えますが、その中でもATP依存性のユビキチンープロテアソーム経路による異常タンパク質の分解を妨げ、細胞内蓄積を促進する可能性があります。したがって、ATPレベルを維持することが神経保護につながると考えられます。総アデニル酸プールは尿酸値に影響するため、これまでの疫学的研究に基づく高尿酸血症と神経保護との関係は、上流の総アデニル酸プールの存在を反映している可能性があります。また、低尿酸血症は総アデニル酸プールの減少を表し、その背景には低栄養、低酸素症や虚血などの病的状態、加齢に伴う様々な機能低下などがある可能性があります。
今後の展望
本研究では、XOR阻害薬、ヒポキサンチン、ペントースの同時投与により、ATPをほぼ飽和レベルまで上昇させることができることを示しました。この新たな戦略は神経変性疾患や、エネルギー枯渇や虚血を病態とする疾患の治療に有効である可能性があります。
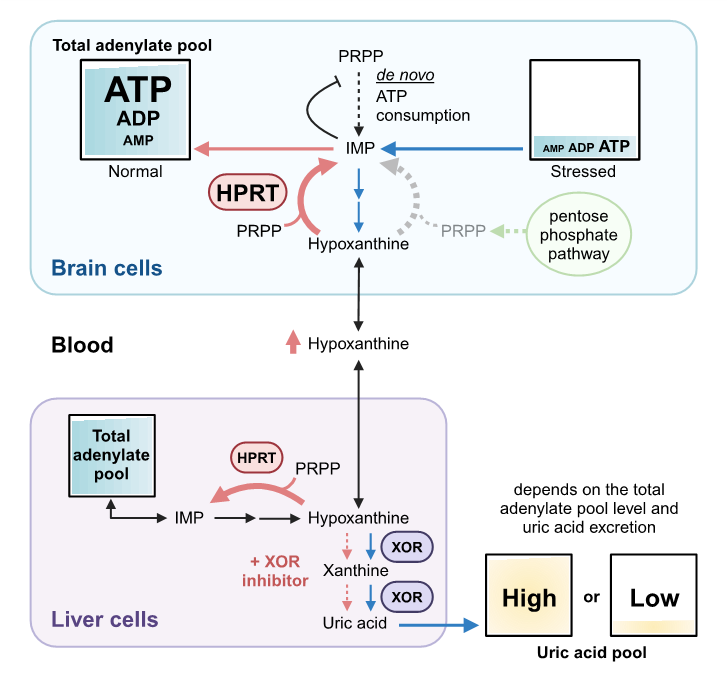 図2. 本研究の概念図
図2. 本研究の概念図
さまざまな生命活動におけるATP消費の結果、アデニンヌクレオチド(ATP, ADP, AMP)の分解が進み、ヒポキサンチンが増加します。ヒポキサンチンはHPRTを介して再利用されますが、細胞内の総アデニル酸が十分であるとき、余剰分は血中に移行し、XOR発現組織(主に肝臓)で尿酸に代謝されます。総アデニル酸プールは過剰な運動、飲酒、ストレスなどによって急激に減少します。持続的なストレス状態は元の総アデニル酸レベルに回復することを妨げ、プリン体分解を進行させます。これらは尿酸プールに影響を与えると考えられます。XOR阻害薬は尿酸生成を抑制することで細胞外のヒポキサンチンを増加させ、ヒポキサンチンはプリンが不足している細胞に取り込まれます。PRPPはプリンde novo 経路の基質でもありますが、通常、低レベルで存在しており、利用可能なヒポキサンチンが存在すると優先的にサルベージ経路が働きます。その過程で生じたIMPやAMPはde novo 経路の律速段階をフィードバック阻害し、代謝全体としてATP消費を抑えることができます。PRPPが枯渇するとサルベージが停滞するため、ペントースリン酸経路を介したPRPPの供給はサルベージの維持に有効です。Created with BioRender.com
用語解説
-
- 尿酸:細胞の核酸やATPの構成成分であるプリン体が代謝された最終産物であり、強い抗酸化作用を持ちますが、尿酸値が高いと高尿酸血症や痛風などを引き起こします。
- キサンチン酸化還元酵素:プリン代謝の最終段階であるヒポキサンチンからキサンチン、キサンチンから尿酸への反応を触媒する酵素であり、高尿酸血症・痛風治療薬の標的となっています。
- プリンサルベージ経路:プリン塩基を再利用してプリンヌクレオチドを合成する経路です。
- ヒポキサンチンホスホリボシルトランスフェラーゼ:PRPPをつかってヒポキサンチン、グアニンをそれぞれ対応するプリンヌクレオチド(IMP、GMP)に変換する酵素です。
- プリンde novo 経路:いくつかのアミノ酸とギ酸から多段階の過程を経て新規にプリンヌクレオチドを合成する経路であり、ATPを消費します。
- ペントースリン酸経路:解糖系から分岐する経路であり、出発基質であるグルコース-6-リン酸からペントースリン酸と酸化還元恒常性に関与するNADPHを産生します。PRPPはペントースリン酸経路でつくられたリボース-5-リン酸から合成されます。
研究助成
本研究は、日本学術振興会科学研究費助成事業(課題番号:15H04702, 21KK0173, 24K19311)、および痛風・尿酸財団の助成などの支援により実施されました。
原著論文情報
Mai Sekine, Megumi Fujiwara, Ken Okamoto, Kimiyoshi Ichida, Koji Nagata, Russ Hille, Takeshi Nishino
Published online: July 01, 2024, 107524
DOI:https://doi.org/10.1016/j.jbc.2024.107524発表者
関根 舞(東京大学大学院農学生命科学研究科 博士課程:当時、現在・東京薬科大学 助教)
藤原めぐみ(日本医科大学 助教)
岡本 研(東京大学大学院農学生命科学研究科 特任研究員)
市田 公美(東京薬科大学大学薬学部 教授:当時)
永田 宏次(東京大学大学院農学生命科学研究科 教授)
Russ Hille(カリフォルニア大学リバーサイド校 教授)
西野 武士(東京大学大学院農学生命科学研究科特任教授:当時、日本医科大学 名誉教授)-
-
-
-
-
関連リンク
-
-
-
-
取材に関するお問い合わせ先
- 東京薬科大学 入試・広報センター 広報担当
-
- 042-676-4921(8:45~17:00 月~金、祝日は除く)
- お問い合わせフォーム
研究に関するお問い合わせ先
- 東京薬科大学 薬学部 創剤科学教室 助教 関根 舞








