研究活動研究者が語る 東薬の先端研究 翻訳後修飾を操ることにより生命を理解し、疾患の治療薬を作る
伊藤 昭博 教授
生命科学部 分子生命科学科 細胞情報科学研究室
翻訳後修飾とは?
生命の設計図はDNAですが、DNA自身が生命活動を行っている訳ではありません。DNAの設計図通りにセントラルドグマにより作られたタンパク質が実際の生命活動を行っています。DNAの設計図、すなわちDNAの塩基配列にしたがって作られたタンパク質は、そのままの姿で機能するものは稀で、多くのタンパク質は翻訳後に様々な修飾(翻訳後修飾)を受けます。翻訳後修飾には様々な種類があり、メチル化やアセチル化などの低分子化合物が結合する場合や、タンパク質や糖などの高分子化合物が結合する場合もあります。これら翻訳後修飾によってタンパク質の機能が調節されています。すなわち、タンパク質がどのような機能を持っているのかは、ゲノムDNA中にコードされているアミノ酸配列によって決まりますが、タンパク質がいつ、どこで、どのように働くかは、翻訳後修飾によって決まります。

翻訳後修飾は細胞の運命を決定する
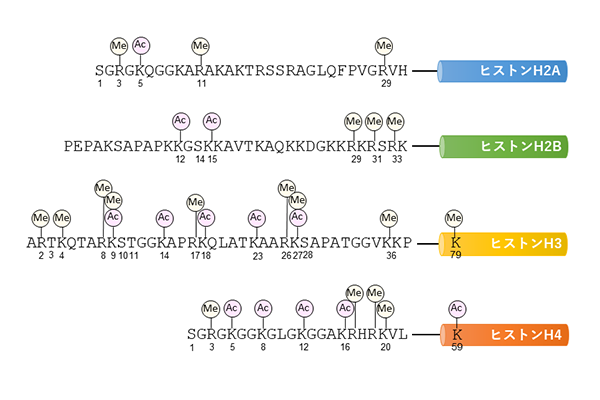 図1
図1
ヒトの身体は約37兆個の細胞からできていますが、元を辿れば一個の受精卵から始まっています。したがって、37兆個の細胞のDNAの塩基配列は全て一緒です。しかし、我々の体は様々な種類の細胞から構成されています。生命の設計図であるDNAの塩基配列が同一であるのに、なぜ異なった細胞が存在するのでしょうか? ヒトの遺伝子の数は約2万1千程度ですが、全ての遺伝子が働いている(発現している)訳ではありません。細胞の種類によって発現している遺伝子は異なっていて、細胞の特徴は、発現している遺伝子の種類(遺伝子の発現パターン)で決まるのです。それでは、この遺伝子の発現パターンはどのようにして調節されているのでしょうか? 真核生物の場合、DNAは核の中でヒストンと呼ばれるタンパク質に巻きついています。このヒストンタンパク質がアセチル化やメチル化といった翻訳後修飾を受けます(図1)。このヒストンのアセチル化およびメチル化修飾によって、周辺の遺伝子の発現が調節されています。ヒストンタンパク質の翻訳後修飾が遺伝子の発現パターンを決め、ひいては細胞の運命を決定しているのです。
翻訳後修飾と疾患
この遺伝子発現パターンがおかしくなると、細胞は正常な機能を保てなくなるので、がんなどの疾患の原因となります。がんの主な原因は、遺伝子の塩基配列の異常(変異)ですが、遺伝子の発現パターンの異常もがんの原因になることが分かってきました。その場合、遺伝子の発現パターンを元に戻してあげれば治療できるということになります。ヒストンを含めたタンパク質の翻訳後修飾は酵素によって可逆的に制御されています。したがって、翻訳後修飾を制御する酵素の活性を調節するような化合物は薬になる可能性があります。実際、ヒストンの脱アセチル化酵素を阻害する化合物は、白血病の治療薬として臨床の場で使われています。
翻訳後修飾を標的とした創薬研究
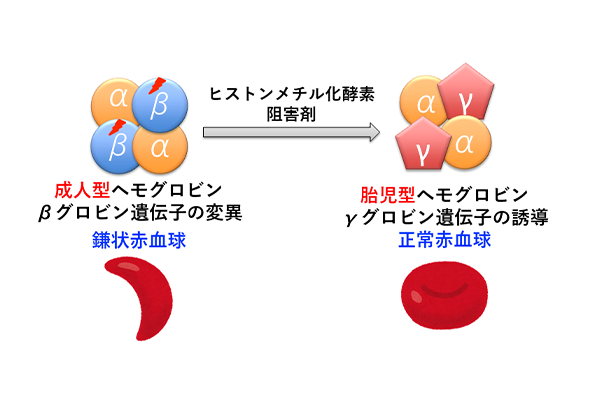 図2
図2
私達は、ヒストンのメチル化を触媒する酵素(ヒストンメチル化酵素)を阻害する化合物を、鎌状赤血球症の治療薬として開発しています。鎌状赤血球症は、成人のヘモグロビンを構成するα鎖とβ鎖のうち、β鎖遺伝子が変異して酸素との結合親和性が低下し、重篤な貧血になる遺伝性の疾患です。日本ではほとんど患者はいませんが、世界では毎年30-40万人の新生児が鎌状赤血球症を発症していて、新しい治療薬の登場が強く望まれています。ヘモグロビンは、胎児の時はα鎖とγ鎖から構成されていますが、生まれた後成人型(α鎖とβ鎖)に変わっていきます。すなわち、生後にγ鎖からβ鎖に遺伝子発現パターンが変化するのです。鎌状赤血球症の原因となるβ鎖遺伝子の変異を元に戻すことは難しいですが、成人で眠っている(発現が抑制されている)γ鎖遺伝子を再び呼び起こし、胎児型ヘモグロビンを誘導することができれば、ヘモグロビンは酸素と結合できるようになります。そのようなγ鎖遺伝子を再活性化させる化合物は、鎌状赤血球症の治療薬になります。私達はそのようなアイデアのもと、ヘモグロビン遺伝子の発現パータン変化させる(γ鎖遺伝子の発現を誘導する)化合物として、ヒストンメチル化酵素の阻害剤を見つけました(図2)。現在、鎌状赤血球症治療薬の創製を目指して創薬研究を進めるとともに、何故ヒストンメチル化酵素が阻害されると眠っていたγ鎖遺伝子の発現が再活性化されるのか、そのメカニズムの究明に取り組んでいます。
新しい翻訳後修飾の機能解明から創薬へ
ヒストン以外にも様々なタンパク質が翻訳後修飾されます。例えば、ヒトの細胞では、アセチル化されるタンパク質はヒストン以外に3,000種類以上存在することが示唆されています。しかし、その機能が明らかになっているのはごく一部です。また、翻訳後修飾の種類も様々で、中には機能がほとんど分かっていない修飾も存在します。私達は、ヒストンの翻訳後修飾に加えて、機能未知の翻訳後修飾についても研究を進めています。新しい翻訳後修飾による生命機能調節機構の解明に挑むとともに、疾患関与についても明らかにし、創薬へと繋げていきたいと考えています。
東京薬科大学で研究をしてみよう
大学における研究は学生が主役です。私達の研究室では、学生自身が、翻訳後修飾を操る化合物を自ら探してきて、それを用いて翻訳後修飾の機能の解明や、疾患との関係、さらには創薬を夢見て研究を行っています。翻訳後修飾をキーワードに、未知な生命機能制御機構を明らかにしたい、疾患の新しい治療法の開発に繋がる研究がしたい、さらには薬の種となる化合物を見つけたいと思う方は、私達と一緒に研究をしてみませんか?










