研究活動研究者が語る 東薬の先端研究 ~構造生物学~ いのちの仕組みの理解と、創薬基盤
三島 正規 教授
薬学部 医療衛生薬学科 分子生物物理学教室
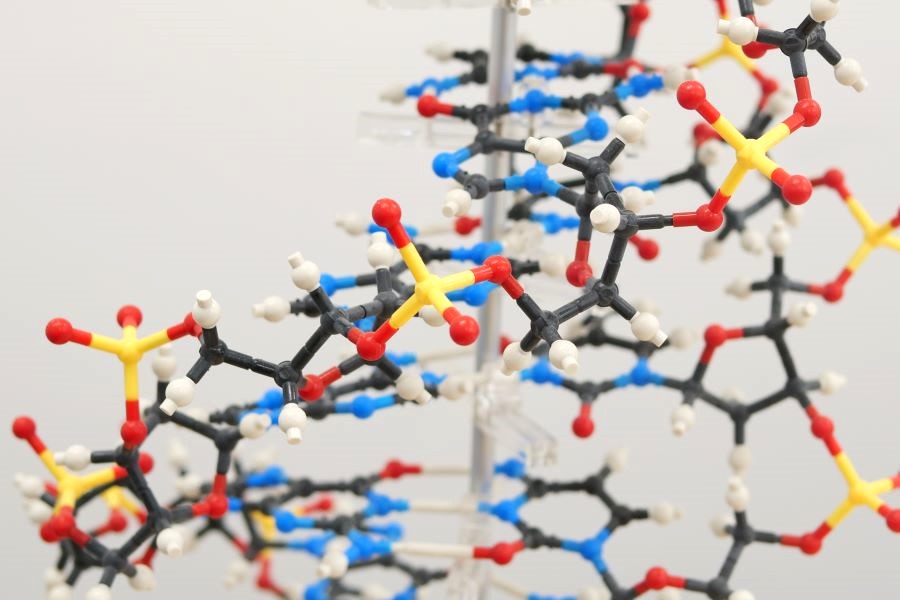
タンパク質のかたちを知る。
タンパク質のかたちを知るために。
構造生物学の目標は、「いのち」を、タンパク質を代表とする生体高分子から構成される分子機械とみなし、その動作原理を理解することです。研究を推進するために、多次元NMR法、X線結晶構造解析法といった物理学的手法に加えて、研究試料調製のための生化学や、有機合成化学を用います。私達の特色は、タンパク質分子中の水素原子の情報や、動的構造解析が可能な多次元NMRを使い、また分子構造解析の王道といえるX線結晶構造解析法も用いることです。中性子線結晶構造解析法や、近年発展の著しいクライオ電子顕微鏡による単粒子解析も取り入れています。分子の機能、性質、構造を統合的に理解することを目指しています。

タンパク質のかたちを知り、いのちの仕組みを理解する。そして創薬へ。
構造生物学の成果は、いのちのしくみの「解明」だけにとどまらず、なぜ薬が効くのかという「理解」、また薬の開発という「応用」面を大きく前進させます。
私達のテーマの例をあげると、細胞の機械刺激応答(メカノセンシング)に関わり、腫瘍形成に関与するタンパク質の構造解析や、細胞内の微小管伸長を促進するタンパク質を阻害する分子の開発があります。これは新規な抗がん剤開発の基礎となります。医学・薬学の観点から重要な生体高分子、さらには生体内の重要な現象について構造解析を推進していきます。
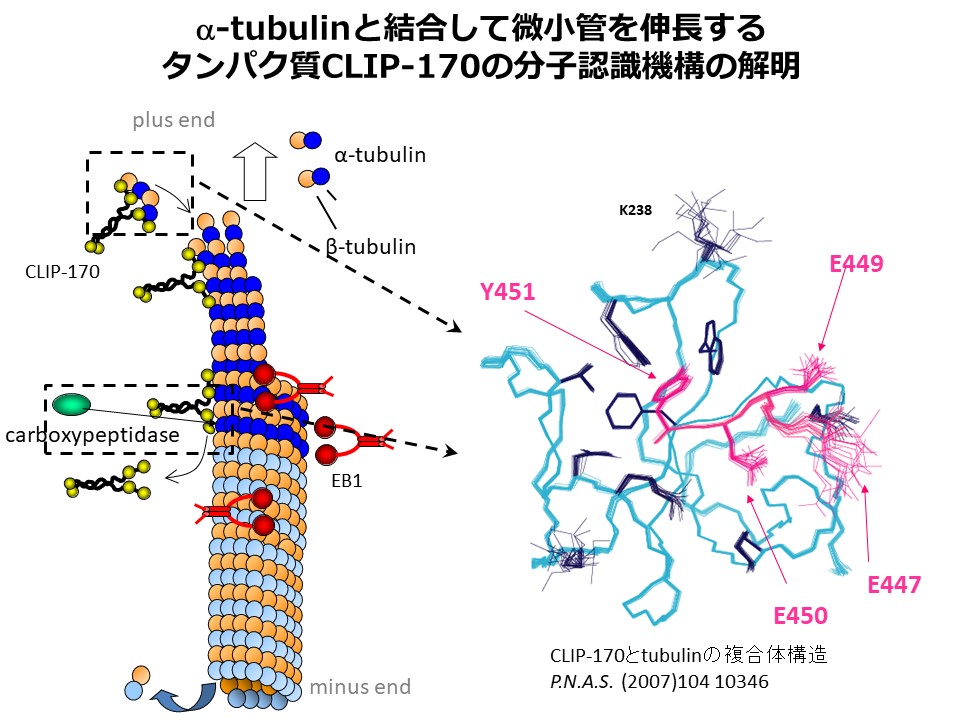
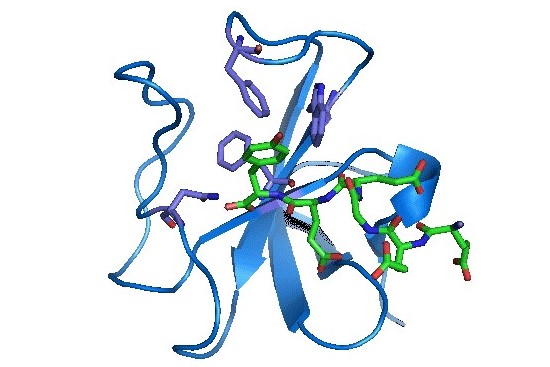
新たな相互作用メカニズムの発見と、その普遍性の追求
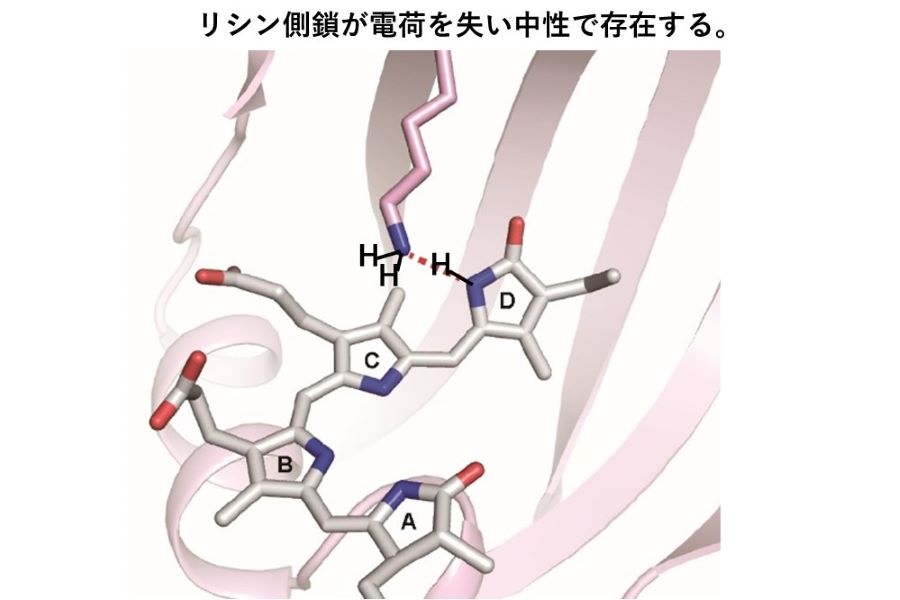
タンパク質は基本的には、20種類のアミノ酸でできています。側鎖といわれる部分に、プラス電荷をもつ塩基性のもの(リシン/アルギニン)や、マイナス電荷をもつ酸性のもの(グルタミン酸/アスパラギン酸)があることは高校や大学で学習します。プラス電荷をもつアミノ酸の側鎖とマイナス電荷をもつアミノ酸の側鎖の間には、一種の水素結合が形成されて、タンパク質の立体構造形成に関わっていることは生化学の常識であり、大学初等レベルの教科書に記載されています。最近、私たちは、タンパク質内部でアミノ酸リシンの側鎖が電荷を失い、中性となり、従来提唱されていた水素結合とは全く異なるタイプの水素結合が形成されることを、センサータンパク質の構造解析の過程で発見しました。この新しい水素結合の形成の仕組みと普遍性を追求します。
薬学における構造生物学・分子生物物理学分野の研究人材の育成
分子生物物理学教室では多次元NMR法、X線結晶構造解析、有機化学、生化学など、多様な技術を用いて基礎研究を推進しています。これらの力をしっかり身に着けた薬学を担う人材を輩出したいと思います。










